题目内容
9.关于1mol/L K2SO4溶液的下列说法正确的是( )| A. | 溶液中含有1mol K2SO4 | B. | 1molK2SO4溶于1L水中 | ||
| C. | 溶液中c(K+ )=2mol/L | D. | 1L 溶液中含2molK+,4mol O2- |
分析 1mol/L K2SO4溶液,若溶液体积为1L,则含溶质为1L×1mol/L=1mol,含2molK+,1mol SO42-,c(K+ )=2mol/L,以此来解答.
解答 解:A.溶液体积未知,不能计算溶质的物质的量,故A错误;
B.1L水为溶剂的体积,不是溶液的体积,故B错误;
C.溶液中c(K+ )=1mol/L×2=2mol/L,故C正确;
D.溶液中不含O2-,1L 溶液中含2molK+,1mol SO42-,故D错误;
故选C.
点评 本题考查物质的量浓度的计算,为高频考点,把握体积、浓度与物质的量的关系为解答的关键,侧重分析与计算能力的考查,注意物质的构成,题目难度不大.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
19.2012年6月16日我国成功发射了“神州九号”.这标志着中国人的太空时代又前进了一大步.发射“神九”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气.已知:
N2(g)+2O2(g)═2NO2(g);△H=+67.7kJ/mol
N2H4(g)+O2(g)═N2(g)+2H2O(g);△H=-534kJ/mol
下列关于肼和NO2反应的热化学方程式中,正确的是( )
N2(g)+2O2(g)═2NO2(g);△H=+67.7kJ/mol
N2H4(g)+O2(g)═N2(g)+2H2O(g);△H=-534kJ/mol
下列关于肼和NO2反应的热化学方程式中,正确的是( )
| A. | 2N2H4(g)+2NO2(g)═3N2(g)+4H2O(l);△H=-1135.7 kJ/mol | |
| B. | 2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g);△H=-1000.3 kJ/mol | |
| C. | N2H4(g)+NO2(g)═N2(g)+2H2O(l);△H=-1135.7 kJ/mol | |
| D. | 2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g);△H=-1135.7 kJ/mol |
20.下列实验操作不正确的是( )
| A. | 将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,反复多次,完成乙醇氧化为乙醛的实验 | |
| B. | 实验室制取乙炔时,用饱和食盐水代替蒸馏水,以得到平稳的气流 | |
| C. | 向试管中先加入无水乙醇,再加入适量冰醋酸与一定量浓硫配制的混酸,然后加热制取乙酸乙酯 | |
| D. | 验证蔗糖水解产物时,将反应后的溶液与银氨溶液混合水浴加热,观察现象 |
4.化学是一门以实验为基础的学科,化学实验是化学学习的重要内容.根据你掌握的知识判断,下列实验操作的描述中,正确的是( )
| A. | 向试管中滴加液体时,胶头滴管紧贴试管内壁 | |
| B. | 制作Fe(OH)3胶体时,应将蒸馏水与FeCl3溶液混合加热,煮沸至液体呈红褐色 | |
| C. | 各放一张质量相同的滤纸于天平两托盘上,将Na2CO3固体放在右盘纸上称量 | |
| D. | 配制H2SO4溶液时,先在量筒中加一定体积的水,再在搅拌下慢慢加入浓硫酸 |
14.已知丙酮通常是无色的液体,与水互溶,密度小于1g/mL,沸点约为55℃.要将水与丙酮分离出来,选择的方法是( )
| A. | 蒸馏 | B. | 分液 | C. | 过滤 | D. | 蒸发 |
18.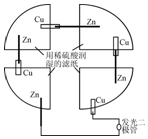 将一张滤纸剪成四等份,用铜片、锌片、发光二极管、导线在玻璃片上连接成如图所示的装置,在四张滤纸上滴入稀H2SO4直至全部润湿.下列叙述正确的是( )
将一张滤纸剪成四等份,用铜片、锌片、发光二极管、导线在玻璃片上连接成如图所示的装置,在四张滤纸上滴入稀H2SO4直至全部润湿.下列叙述正确的是( )
 将一张滤纸剪成四等份,用铜片、锌片、发光二极管、导线在玻璃片上连接成如图所示的装置,在四张滤纸上滴入稀H2SO4直至全部润湿.下列叙述正确的是( )
将一张滤纸剪成四等份,用铜片、锌片、发光二极管、导线在玻璃片上连接成如图所示的装置,在四张滤纸上滴入稀H2SO4直至全部润湿.下列叙述正确的是( )| A. | 锌片上有气泡,铜片溶解 | B. | 电子都是从铜片经外电路流向锌片 | ||
| C. | Zn片发生还原反应 | D. | 该装置至少有两种形式的能量转换 |
13.在体积为2L的恒容密闭容器中发生反应xA(g)+yB(g)?zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系.则下列结论正确的是( )
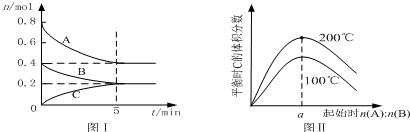

| A. | 200℃时,反应从开始到平衡的平均速率v(B)=0.04 mol•L-1•min-1 | |
| B. | 图Ⅱ所知反应xA(g)+yB(g)?zC(g)的△H<0,且a=2 | |
| C. | 若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆) | |
| D. | 200℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A 的体积分数小于0.5 |