题目内容
13.已烯雌酚是一种激素类药物,结构如图,下列有关叙述中不正确的是( )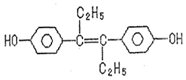
| A. | 可与NaOH和NaHCO3发生反应 | |
| B. | 可以用有机溶剂萃取 | |
| C. | 1mol该有机物可以与5molBr2发生反应 | |
| D. | 该有机物分子中,可能有18个碳原子共平面 |
分析 A.酚羟基能和NaOH或碳酸钠反应,但不能和碳酸氢钠反应;
B.该物质属于有机物,根据相似相溶原理知,该物质易溶于有机物;
C.能和溴发生加成反应的是碳碳双键,苯环上酚羟基邻对位氢原子能和溴发生取代反应;
D.碳碳双键两端的碳原子、苯环上C原子能共平面.
解答 解:A.酚的酸性大于碳酸氢根离子而小于碳酸,所以酚羟基能和NaOH或碳酸钠反应,但不能和碳酸氢钠反应,故A错误;
B.该物质属于有机物,根据相似相溶原理知,有机溶质易溶于有机溶剂,所以该物质易溶于有机物,故B正确;
C.能和溴发生加成反应的是碳碳双键,苯环上酚羟基邻对位氢原子能和溴发生取代反应,则1mol该有机物可以与5molBr2发生反应,故C正确;
D.碳碳双键两端的碳原子、苯环上C原子能共平面,与碳碳双键直接相连的原子可能共面,结合三点确定平面的原子,所有碳原子可能共平面,故D正确;
故选A.
点评 本题考查有机物结构和性质,为高频考点,侧重考查学生分析判断及知识迁移能力,明确官能团及其性质关系是解本题关键,侧重考查烯烃和酚的性质,注意酚和溴发生取代反应位置,易错选项是D.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.化学是一门以实验为基础的学科,化学实验是化学学习的重要内容.根据你掌握的知识判断,下列实验操作的描述中,正确的是( )
| A. | 向试管中滴加液体时,胶头滴管紧贴试管内壁 | |
| B. | 制作Fe(OH)3胶体时,应将蒸馏水与FeCl3溶液混合加热,煮沸至液体呈红褐色 | |
| C. | 各放一张质量相同的滤纸于天平两托盘上,将Na2CO3固体放在右盘纸上称量 | |
| D. | 配制H2SO4溶液时,先在量筒中加一定体积的水,再在搅拌下慢慢加入浓硫酸 |
8.用系统命名法命名下列有机物,名称正确的是( )
| A. | 2-甲基-4-乙基戊烷 | B. | 3,4,4-三甲基己烷 | ||
| C. | 2,3-二甲基-1-戊烯 | D. | 2-乙基丁烷 |
18.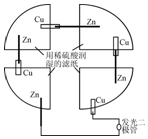 将一张滤纸剪成四等份,用铜片、锌片、发光二极管、导线在玻璃片上连接成如图所示的装置,在四张滤纸上滴入稀H2SO4直至全部润湿.下列叙述正确的是( )
将一张滤纸剪成四等份,用铜片、锌片、发光二极管、导线在玻璃片上连接成如图所示的装置,在四张滤纸上滴入稀H2SO4直至全部润湿.下列叙述正确的是( )
 将一张滤纸剪成四等份,用铜片、锌片、发光二极管、导线在玻璃片上连接成如图所示的装置,在四张滤纸上滴入稀H2SO4直至全部润湿.下列叙述正确的是( )
将一张滤纸剪成四等份,用铜片、锌片、发光二极管、导线在玻璃片上连接成如图所示的装置,在四张滤纸上滴入稀H2SO4直至全部润湿.下列叙述正确的是( )| A. | 锌片上有气泡,铜片溶解 | B. | 电子都是从铜片经外电路流向锌片 | ||
| C. | Zn片发生还原反应 | D. | 该装置至少有两种形式的能量转换 |
5.用已知物质的量浓度的盐酸滴定待测的氢氧化钠溶液,下列情况会使滴定结果偏高的是( )
| A. | 酸式滴定管用水洗净后未用标准液润洗 | |
| B. | 锥形瓶内有水珠未干燥就加入待测的氢氧化钠溶液 | |
| C. | 滴定终点时俯视滴定管读数 | |
| D. | 滴定时溶液刚变成无色就立即停止滴定 |
17.为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施.化学反应的反应热通常用实验进行测定,也可进行理论推算.
(1)实验测得,5g甲醇(CH3OH)液体在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,则表示甲醇标准燃烧热的热化学方程为:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1452.8kJ/mol.
(2)今有如下两个热化学方程式:?则a>b(填“>”、“=”或“<”)
2H2(g)+O2(g)═2H2O(g)△H1=a kJ•mol-1?
2H2(g)+O2(g)═2H2O(l)△H2=b kJ•mol-1?
(3)
已知反应N2(g)+3H2(g)═2NH3(g)△H=a kJ•mol-1.试根据表中所列键能数据估算a 的值:-93(注明“+”或“-”).
(4)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算.利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)═CH3OH(g)△H=-90.8kJ•mol-1[
②2CH3OH(g)═CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
③CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.3kJ•mol-1
总反应:3H2(g)+3CO(g)═CH3OCH3(g)+CO2(g)的△H=-246.4 kJ•mol-1.
(1)实验测得,5g甲醇(CH3OH)液体在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,则表示甲醇标准燃烧热的热化学方程为:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1452.8kJ/mol.
(2)今有如下两个热化学方程式:?则a>b(填“>”、“=”或“<”)
2H2(g)+O2(g)═2H2O(g)△H1=a kJ•mol-1?
2H2(g)+O2(g)═2H2O(l)△H2=b kJ•mol-1?
(3)
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 945 |
(4)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算.利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)═CH3OH(g)△H=-90.8kJ•mol-1[
②2CH3OH(g)═CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
③CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.3kJ•mol-1
总反应:3H2(g)+3CO(g)═CH3OCH3(g)+CO2(g)的△H=-246.4 kJ•mol-1.
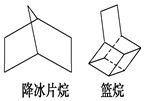 如图都是简化的碳架结构:
如图都是简化的碳架结构: