题目内容
6.将4gNaOH固体溶于水配成250mL溶液,此溶液中NaOH的物质的量浓度为0.4mol/L.从中取出10mL,其物质的量浓度为0.4mol/L,稀释成100mL后,溶液的浓度为0.04mol/L.分析 根据n=$\frac{m}{M}$计算氢氧化钠的物质的量,再根据c=$\frac{n}{V}$计算溶液物质的量浓度,溶液是均匀的,取出10mL溶液的浓度与原溶液浓度相等,根据稀释前后溶质的物质的量不变计算稀释后溶液物质的量浓度.
解答 解:4g NaOH的物质的量为:$\frac{4g}{40g/mol}$=0.1mol,溶于水配成250mL溶液,此溶液中NaOH的物质的量浓度为:$\frac{0.1mol}{0.25L}$=0.4mol/L;
溶液是均匀的,取出10mL溶液的浓度与原溶液浓度相等,仍然为0.4mol/L;
取出10mL溶液中NaOH的物质的量=0.01L×0.4mol/L=0.004mol,将该10mL溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为:$\frac{0.004mol}{0.1L}$=0.04mol/L,
故答案为:0.4;0.4; 0.04.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量与物质的量浓度之间的关系为解答关键,试题侧重基础知识的考查,培养了学生的化学计算能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.已知丙酮通常是无色的液体,与水互溶,密度小于1g/mL,沸点约为55℃.要将水与丙酮分离出来,选择的方法是( )
| A. | 蒸馏 | B. | 分液 | C. | 过滤 | D. | 蒸发 |
18.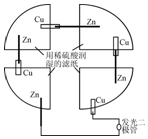 将一张滤纸剪成四等份,用铜片、锌片、发光二极管、导线在玻璃片上连接成如图所示的装置,在四张滤纸上滴入稀H2SO4直至全部润湿.下列叙述正确的是( )
将一张滤纸剪成四等份,用铜片、锌片、发光二极管、导线在玻璃片上连接成如图所示的装置,在四张滤纸上滴入稀H2SO4直至全部润湿.下列叙述正确的是( )
 将一张滤纸剪成四等份,用铜片、锌片、发光二极管、导线在玻璃片上连接成如图所示的装置,在四张滤纸上滴入稀H2SO4直至全部润湿.下列叙述正确的是( )
将一张滤纸剪成四等份,用铜片、锌片、发光二极管、导线在玻璃片上连接成如图所示的装置,在四张滤纸上滴入稀H2SO4直至全部润湿.下列叙述正确的是( )| A. | 锌片上有气泡,铜片溶解 | B. | 电子都是从铜片经外电路流向锌片 | ||
| C. | Zn片发生还原反应 | D. | 该装置至少有两种形式的能量转换 |
15.核内中子数为N的R2+,质量数为A,则ngR2+所含电子的物质的量是( )
| A. | $\frac{n(A-N-2)}{A}$ mol | B. | $\frac{n(A-N+8)}{A+16}$mol | C. | $\frac{n(A-N+8)}{A+8}$mol | D. | $\frac{n(A-N+2)}{A}$mol |
10.(1)反应 Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1;
反应 Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,平衡常数为K2;
在不同温度时K1、K2的值如下表:
反应CO2(g)+H2(g)?CO(g)+H2O(g)△H,平衡常数为K,
则△H=△H1-△H2(用△H1和△H2表示),K=$\frac{{K}_{1}}{{K}_{2}}$(用K1和K2表示),
且由上述计算可知,反应 CO2(g)+H2(g)?CO(g)+H2O(g)是吸热反应(填“吸热”或“放热”).
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应
Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,CO2的浓度与时间的关系如图所示.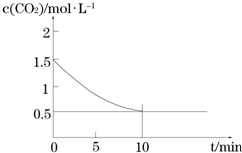
①该条件下反应的平衡常数为2;
②下列措施中能使平衡时$\frac{c(CO)}{c(C{O}_{2})}$增大的是A(填序号).
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉.
反应 Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,平衡常数为K2;
在不同温度时K1、K2的值如下表:
| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
则△H=△H1-△H2(用△H1和△H2表示),K=$\frac{{K}_{1}}{{K}_{2}}$(用K1和K2表示),
且由上述计算可知,反应 CO2(g)+H2(g)?CO(g)+H2O(g)是吸热反应(填“吸热”或“放热”).
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应
Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,CO2的浓度与时间的关系如图所示.

①该条件下反应的平衡常数为2;
②下列措施中能使平衡时$\frac{c(CO)}{c(C{O}_{2})}$增大的是A(填序号).
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉.
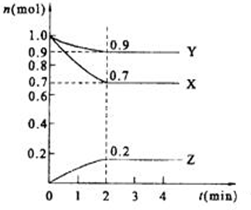 某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示.