题目内容
某学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
(A)移取20.OOmL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至0或O刻度以下,记下读数
(F)把锥形瓶放在滴定管下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空;
(1)正确操作的顺序是(用序号字母填写) .
(2)上述(B)操作的目的是 .
(3)实验中用左手控制 (填仪器及部位),眼睛注视 ,直至滴定终点.判断到达终点的现象是 .
(4)下列情况使结果偏高的是 .
①碱式滴定管用水洗后直接装液体进行滴定;②酸式滴定管水洗后,就用来量取待测盐酸;③锥形瓶用蒸馏水洗涤后,又用待测盐酸润洗;④将待测酸液溅到锥形瓶外;⑤碱液在滴定时滴到锥形瓶外;⑥若称取含少量NaOH的KOH固体配制标准溶液并用来滴定上述盐酸;⑦滴定前,碱式滴定管有气泡,滴定后消失;⑧记录标准碱液起始体积时,仰视读数,终点时俯视.
(A)移取20.OOmL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至0或O刻度以下,记下读数
(F)把锥形瓶放在滴定管下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空;
(1)正确操作的顺序是(用序号字母填写)
(2)上述(B)操作的目的是
(3)实验中用左手控制
(4)下列情况使结果偏高的是
①碱式滴定管用水洗后直接装液体进行滴定;②酸式滴定管水洗后,就用来量取待测盐酸;③锥形瓶用蒸馏水洗涤后,又用待测盐酸润洗;④将待测酸液溅到锥形瓶外;⑤碱液在滴定时滴到锥形瓶外;⑥若称取含少量NaOH的KOH固体配制标准溶液并用来滴定上述盐酸;⑦滴定前,碱式滴定管有气泡,滴定后消失;⑧记录标准碱液起始体积时,仰视读数,终点时俯视.
考点:中和滴定
专题:实验题
分析:(1)根据中和滴定有检漏、洗涤、润洗、装液、取待测液并加指示剂、滴定等操作;
(2)滴定管在装液时,为了防止溶液被稀释,需用待装液润洗;
(3)实验中应控制流速并观察锥形瓶中颜色变化;如溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(4)根据c(待测)=
分析不当操作对V(标准)的影响,以此判断;
(2)滴定管在装液时,为了防止溶液被稀释,需用待装液润洗;
(3)实验中应控制流速并观察锥形瓶中颜色变化;如溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(4)根据c(待测)=
| V(标准)×c(标准) |
| V(待测) |
解答:
解:(1)中和滴定按照检漏、洗涤、润洗、装液、取待测液并加指示剂、滴定等顺序操作,则正确的顺序为BDCEAF,
故答案为:BDCEAF;
(2)上述(B)操作的目的是防止将标准液稀释,
故答案为:防止将标准液稀释;
(3)滴定时,滴定过程中,用左手控制碱式滴定管橡皮管玻璃珠处,右手摇动锥形瓶,两眼应该注视锥形瓶内溶液的颜色变化;滴定时,锥形瓶中溶液的颜色由无色变浅红且保持30秒内不褪色,可说明达到滴定终点;
故答案为:碱式滴定管橡皮管玻璃珠处;锥形瓶中溶液的颜色变化;锥形瓶中溶液的颜色由无色变浅红且保持30秒内不褪色;
(4)①碱式滴定管用水洗后直接装液体进行滴定,KOH溶液被稀释,所用KOH溶液体积偏大,所测盐酸浓度偏大,故①正确;
②酸式滴定管水洗后,就用来量取待测盐酸,盐酸被稀释,待测液的物质的量偏小,所用KOH溶液体积偏小,所测盐酸浓度偏小,故②错误;
③锥形瓶用蒸馏水洗涤后,又用待测盐酸润洗,待测液的物质的量偏大,所用KOH溶液体积偏大,所测盐酸浓度偏大,故③正确;
④将待测酸液溅到锥形瓶外,待测液的物质的量偏小,所用KOH溶液体积偏小,所测盐酸浓度偏小,故④错误;
⑤碱液在滴定时滴到锥形瓶外,所用KOH溶液体积偏大,所测盐酸浓度偏大,故⑤正确;
⑥同质量的氢氧化钠和氢氧化钾,氢氧化钠的物质的量大于氢氧化钾的物质的量,所以若称取含少量NaOH的KOH固体配制标准溶液,造成V(标)偏小,所测盐酸浓度偏小,故⑥错误;
⑦滴定前,碱式滴定管有气泡,滴定后消失,所用KOH溶液体积偏大,所测盐酸浓度偏大,故⑦正确;
⑧记录标准碱液起始体积时,仰视读数,终点时俯视,所用KOH溶液体积偏小,所测盐酸浓度偏小,故⑧错误;
故答案为:①③⑤⑦;
故答案为:BDCEAF;
(2)上述(B)操作的目的是防止将标准液稀释,
故答案为:防止将标准液稀释;
(3)滴定时,滴定过程中,用左手控制碱式滴定管橡皮管玻璃珠处,右手摇动锥形瓶,两眼应该注视锥形瓶内溶液的颜色变化;滴定时,锥形瓶中溶液的颜色由无色变浅红且保持30秒内不褪色,可说明达到滴定终点;
故答案为:碱式滴定管橡皮管玻璃珠处;锥形瓶中溶液的颜色变化;锥形瓶中溶液的颜色由无色变浅红且保持30秒内不褪色;
(4)①碱式滴定管用水洗后直接装液体进行滴定,KOH溶液被稀释,所用KOH溶液体积偏大,所测盐酸浓度偏大,故①正确;
②酸式滴定管水洗后,就用来量取待测盐酸,盐酸被稀释,待测液的物质的量偏小,所用KOH溶液体积偏小,所测盐酸浓度偏小,故②错误;
③锥形瓶用蒸馏水洗涤后,又用待测盐酸润洗,待测液的物质的量偏大,所用KOH溶液体积偏大,所测盐酸浓度偏大,故③正确;
④将待测酸液溅到锥形瓶外,待测液的物质的量偏小,所用KOH溶液体积偏小,所测盐酸浓度偏小,故④错误;
⑤碱液在滴定时滴到锥形瓶外,所用KOH溶液体积偏大,所测盐酸浓度偏大,故⑤正确;
⑥同质量的氢氧化钠和氢氧化钾,氢氧化钠的物质的量大于氢氧化钾的物质的量,所以若称取含少量NaOH的KOH固体配制标准溶液,造成V(标)偏小,所测盐酸浓度偏小,故⑥错误;
⑦滴定前,碱式滴定管有气泡,滴定后消失,所用KOH溶液体积偏大,所测盐酸浓度偏大,故⑦正确;
⑧记录标准碱液起始体积时,仰视读数,终点时俯视,所用KOH溶液体积偏小,所测盐酸浓度偏小,故⑧错误;
故答案为:①③⑤⑦;
点评:本题考查酸碱中和滴定实验,难度不大,注意把握实验的原理、步骤、方法以及注意事项,把握实验基本操作.

练习册系列答案
相关题目
下列关于胶体的叙述中不正确的是( )
| A、丁达尔现象可用来区别胶体与溶液 |
| B、胶体粒子能通过半透膜,不能通过滤纸 |
| C、胶体不稳定,在一定条件下会发生聚沉 |
| D、溶液、胶体、浊液的根本区别是分散质粒子直径的大小 |
 下表是元素周期表一部分,表中所列字母分别代表某一化学元素.
下表是元素周期表一部分,表中所列字母分别代表某一化学元素.
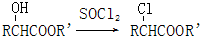 (R,R′代表氢原子或氰基)
(R,R′代表氢原子或氰基)