题目内容
某同学用一定物质的量浓度的NaOH标准溶液来测定未知浓度的盐酸的浓度:
(1)配制250mL 0.5mol/L的NaOH标准溶液所需的称量的质量NaOH为 g.
(2)滴定操作:在锥形瓶的待测液中滴加2-3滴酚酞试液,并开始滴定.
手眼:左手 ,右手摇动锥形瓶,眼睛
滴速:先快后慢,当接近终点时,应一滴一摇.
终点的判断:最后一滴NaOH溶液刚好使指示剂颜色由 且半分钟不褪色,即到终点,读出体积并记录.
(3)用滴定管准确量取20.00mL未知浓度的盐酸于锥形瓶中,加入酚酞作指示剂,用NaOH溶液滴定到终点.
该同学进行了三次实验,实验数据如下表:
滴定中误差较大的是第 次实验.
造成这种误差的可能原因是 (填选项编号)
a、在盛装未知浓度的盐酸之前锥形瓶里面有少量蒸馏水,未烘干
b、滴定管在盛装标准NaOH溶液前未润洗
c、滴定开始前盛装标准NaOH溶液的滴定管尖嘴部分有气泡,滴定终点读数时未发现气泡
d、滴定开始前盛装标准NaOH溶液的滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
e、滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来
f、达到滴定终点时,俯视溶液凹液面最低点读数
(4)该同学所测得盐酸的物质的量浓度为 (结果保留三位小数).
(1)配制250mL 0.5mol/L的NaOH标准溶液所需的称量的质量NaOH为
(2)滴定操作:在锥形瓶的待测液中滴加2-3滴酚酞试液,并开始滴定.
手眼:左手
滴速:先快后慢,当接近终点时,应一滴一摇.
终点的判断:最后一滴NaOH溶液刚好使指示剂颜色由
(3)用滴定管准确量取20.00mL未知浓度的盐酸于锥形瓶中,加入酚酞作指示剂,用NaOH溶液滴定到终点.
该同学进行了三次实验,实验数据如下表:
| 实验编号 | 盐酸的体积(mL) | 标准NaOH溶液的体积(mL) |
| ① | 均是20.00 | 18.20 |
| ② | 17.10 | |
| ③ | 16.90 |
造成这种误差的可能原因是
a、在盛装未知浓度的盐酸之前锥形瓶里面有少量蒸馏水,未烘干
b、滴定管在盛装标准NaOH溶液前未润洗
c、滴定开始前盛装标准NaOH溶液的滴定管尖嘴部分有气泡,滴定终点读数时未发现气泡
d、滴定开始前盛装标准NaOH溶液的滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
e、滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来
f、达到滴定终点时,俯视溶液凹液面最低点读数
(4)该同学所测得盐酸的物质的量浓度为
考点:中和滴定
专题:实验题
分析:(1)利用n=cV、m=n×M来计算NaOH的质量;
(2)实验中应控制流速并观察锥形瓶中颜色变化;如溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(3)对比表中数据,误差较大的是第1次实验,需要标准液的体积偏大;根据c(待测)=
分析不当操作对V(标准)的影响,以此判断;
(4)先判断数据的有效性,然后求出平均值,最后根据关系式HCl~NaOH来计算出盐酸的浓度;
(2)实验中应控制流速并观察锥形瓶中颜色变化;如溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(3)对比表中数据,误差较大的是第1次实验,需要标准液的体积偏大;根据c(待测)=
| V(标准)×c(标准) |
| V(待测) |
(4)先判断数据的有效性,然后求出平均值,最后根据关系式HCl~NaOH来计算出盐酸的浓度;
解答:
解:(1)配制250mL 0.5mol/L的NaOH标准溶液所需的称量的质量NaOH为0.25L×0.5mol/L×40g/mol=5.0g;
故答案为:5.0;
(2)滴定时,滴定过程中,用左手控制碱式滴定管橡皮管玻璃珠处,右手摇动锥形瓶,两眼应该注视锥形瓶内溶液的颜色变化;滴定时,锥形瓶中溶液的颜色由无色变浅红且保持30秒内不褪色,可说明达到滴定终点;
故答案为:碱式滴定管橡皮管玻璃珠处;锥形瓶中溶液的颜色变化;由无色变浅红;
(3)对比表中数据,误差较大的是第①次实验,需要标准液的体积偏大;
a、在盛装未知浓度的盐酸之前锥形瓶里面有少量蒸馏水,未烘干,待测液的物质的量不变,所用NaOH溶液体积不变,所测盐酸浓度不变,故a错误;
b、滴定管在盛装标准NaOH溶液前未润洗,标准NaOH溶液被稀释,所用NaOH溶液体积偏大,所测盐酸浓度偏大,故b正确;
c、滴定开始前盛装标准NaOH溶液的滴定管尖嘴部分有气泡,滴定终点读数时未发现气泡,所用NaOH溶液体积偏大,所测盐酸浓度偏大,故c正确;
d、滴定开始前盛装标准NaOH溶液的滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡,所用NaOH溶液体积偏小,所测盐酸浓度偏小,故d错误;
e、滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来,所用NaOH溶液体积偏小,所测盐酸浓度偏小,故e错误;
f、达到滴定终点时,俯视溶液凹液面最低点读数,所用NaOH溶液体积偏小,所测盐酸浓度偏小,故f错误;
故选:bc;
(4)数据①无效,取②、③体积进行计算,所用标准液的平均体积为17.00mL,
HCl~NaOH
1 1
C(HCl)×20.00mL 0.5mol/L×17.00mL;
解得:C(HCl)=0.425mol/L,故答案为:0.425;
故答案为:5.0;
(2)滴定时,滴定过程中,用左手控制碱式滴定管橡皮管玻璃珠处,右手摇动锥形瓶,两眼应该注视锥形瓶内溶液的颜色变化;滴定时,锥形瓶中溶液的颜色由无色变浅红且保持30秒内不褪色,可说明达到滴定终点;
故答案为:碱式滴定管橡皮管玻璃珠处;锥形瓶中溶液的颜色变化;由无色变浅红;
(3)对比表中数据,误差较大的是第①次实验,需要标准液的体积偏大;
a、在盛装未知浓度的盐酸之前锥形瓶里面有少量蒸馏水,未烘干,待测液的物质的量不变,所用NaOH溶液体积不变,所测盐酸浓度不变,故a错误;
b、滴定管在盛装标准NaOH溶液前未润洗,标准NaOH溶液被稀释,所用NaOH溶液体积偏大,所测盐酸浓度偏大,故b正确;
c、滴定开始前盛装标准NaOH溶液的滴定管尖嘴部分有气泡,滴定终点读数时未发现气泡,所用NaOH溶液体积偏大,所测盐酸浓度偏大,故c正确;
d、滴定开始前盛装标准NaOH溶液的滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡,所用NaOH溶液体积偏小,所测盐酸浓度偏小,故d错误;
e、滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来,所用NaOH溶液体积偏小,所测盐酸浓度偏小,故e错误;
f、达到滴定终点时,俯视溶液凹液面最低点读数,所用NaOH溶液体积偏小,所测盐酸浓度偏小,故f错误;
故选:bc;
(4)数据①无效,取②、③体积进行计算,所用标准液的平均体积为17.00mL,
HCl~NaOH
1 1
C(HCl)×20.00mL 0.5mol/L×17.00mL;
解得:C(HCl)=0.425mol/L,故答案为:0.425;
点评:本题考查酸碱中和滴定实验,题目难度不大,注意把握实验的原理、步骤、方法以及注意事项,把握实验基本操作.

练习册系列答案
相关题目
某元素的一个原子形成的离子可表示为
Xn-,下列说法正确的是( )
b a |
A、
| ||
B、
| ||
C、X原子的质量数为
| ||
D、X原子的质量约为
|
1L稀硝酸和稀硫酸的混合液,其物质的量浓度分别为0.1mol?l-1和0.4mol?l-1.若向该混合液中加入足量的铜粉,则最多能溶解铜粉的质量为( )
| A、2.4g | B、3.2g |
| C、6.4g | D、9.6g |
己烯雌酚是一种激素类药物,结构如下.下列有关叙述中不正确的是( )
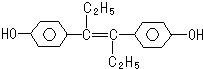

| A、该有机物分子中,至少8个碳原子一定共平面 |
| B、可与NaOH和NaHCO3发生反应 |
| C、1mol该有机物可以与5mol Br2发生反应 |
| D、它易溶于有机溶剂 |
已知1mol某态烃CmHn完全燃烧时,需要耗氧气5mol;则m与n的下列关系正确的是( )
| A、m=8+n | ||
| B、m=10-n | ||
C、m=5-
| ||
| D、m=12-n |
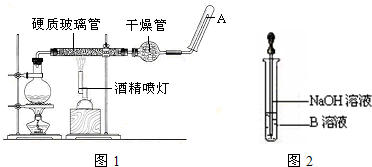
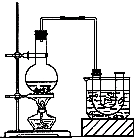 已知:CH3CH2OH+NaBr+H2SO4(浓)
已知:CH3CH2OH+NaBr+H2SO4(浓)