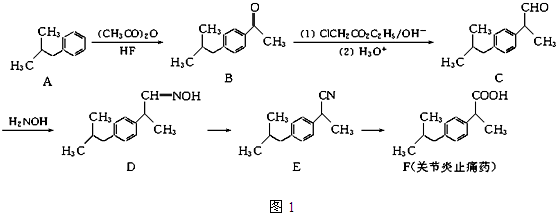
题目内容
下列选项中,有关实验操作、现象和结论都正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将过量的SO2通入Ba(NO3)2溶液中 | 有白色沉淀生成 | 生成了BaSO3 |
| B | 常温下将Al片插入浓硫酸中 | 无明显现象 | Al片和浓硫酸不反应 |
| C | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| D | 将SO2通入溴水中 | 溶液褪色 | SO2具有漂白性 |
| A、A | B、B | C、C | D、D |
考点:化学实验方案的评价,氨的化学性质,二氧化硫的化学性质,浓硫酸的性质
专题:实验评价题,氧族元素
分析:A.将过量的SO2通入Ba(NO3)2溶液中,发生氧化还原反应生成硫酸钡沉淀;
B.常温下将Al片插入浓硫酸中,发生钝化;
D.显碱性的溶液可使红色石蕊试纸变蓝;
D.SO2通入溴水中,发生氧化还原反应生成硫酸和HBr.
B.常温下将Al片插入浓硫酸中,发生钝化;
D.显碱性的溶液可使红色石蕊试纸变蓝;
D.SO2通入溴水中,发生氧化还原反应生成硫酸和HBr.
解答:
解:A.将过量的SO2通入Ba(NO3)2溶液中,发生氧化还原反应生成硫酸钡沉淀,结论不合理,故A错误;
B.常温下将Al片插入浓硫酸中,发生钝化,生成致密的氧化膜阻止反应的进一步发生,结论不合理,故B错误;
D.显碱性的溶液可使红色石蕊试纸变蓝,则用玻璃棒蘸取浓氨水点到红色石蕊试纸上,试纸变蓝说明氨水显碱性,故C正确;
D.SO2通入溴水中,发生氧化还原反应生成硫酸和HBr,体现二氧化硫的还原性,结论不合理,故D错误;
故选C.
B.常温下将Al片插入浓硫酸中,发生钝化,生成致密的氧化膜阻止反应的进一步发生,结论不合理,故B错误;
D.显碱性的溶液可使红色石蕊试纸变蓝,则用玻璃棒蘸取浓氨水点到红色石蕊试纸上,试纸变蓝说明氨水显碱性,故C正确;
D.SO2通入溴水中,发生氧化还原反应生成硫酸和HBr,体现二氧化硫的还原性,结论不合理,故D错误;
故选C.
点评:本题考查化学实验方案的评价,为高频考点,把握物质的性质及氧化还原反应原理为解答的关键,侧重氧化还原反应及现象的分析及应用的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
对于反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,下列说法正确的是( )
| A、只有硫酸铜作氧化剂 |
| B、SO42-既不是氧化产物又不是还原产物 |
| C、被氧化与被还原的硫元素的质量比为3:7 |
| D、当有1mol硫酸铜参加反应时,该反应转移1mol电子 |
己烯雌酚是一种激素类药物,结构如下.下列有关叙述中不正确的是( )
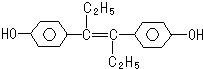

| A、该有机物分子中,至少8个碳原子一定共平面 |
| B、可与NaOH和NaHCO3发生反应 |
| C、1mol该有机物可以与5mol Br2发生反应 |
| D、它易溶于有机溶剂 |
电解质溶液有许多奇妙之处,你只有深入思考,才能体会到它的乐趣.下列关于电解质溶液的叙述中正确的是( )
| A、Na2CO3、NaHCO3两种盐溶液中,离子种类不相同 |
| B、常温下,1mol/L的CH3COOH溶液与1mol/L的NaOH溶液等体积混合,所得混合液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| C、物质的量浓度相同的NH4Cl和NH4HSO4两种溶液中,c(NH4+)前者小于后者 |
| D、常温下,某溶液中有水电离出的c(H+)=10-51mol?L-1,则此溶液可能是盐酸 |
用括号内的试剂和方法除去下列各种物质的少量杂质,不正确的是( )
| A、苯中含有苯酚(浓溴水,过滤) |
| B、乙酸钠中含有碳酸钠(乙酸,蒸发) |
| C、乙酸乙酯中含有乙酸(饱和碳酸钠溶液,分液) |
| D、溴乙烷中含有醇(水,分液) |
已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )
| A、含氧酸的酸性:X对应的酸性强于Y对应的酸性 |
| B、第一电离能Y不一定小于X |
| C、X与Y形成化合物时,X显负价,Y显正价 |
| D、Y的气态氢化物的稳定性小于X气态氢化物的稳定性 |
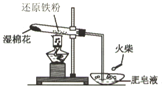 为探究铁和铁的化合物的一些化学性质,某学生实验小组设计了以下实验.
为探究铁和铁的化合物的一些化学性质,某学生实验小组设计了以下实验.