题目内容
6.下面是自来水生产的流程示意图: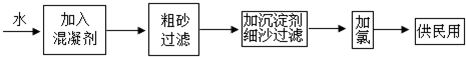
(1)混凝剂除去杂质的过程③(填写序号).
①只有物理变化
②只有化学变化
③既有物理变化也有化学变化
FeSO4•7H2O是常用的混凝剂,在水体中最终生成Fe(OH)3(填“Fe(OH)2”或“Fe(OH)3”),请用离子方程式表示这一过程4Fe2++O2+10H2O=4Fe(OH)3+8H+.
(2)要除去水体中含有的Ca2+、Mg2+.可选择生石灰和纯碱作沉淀剂,应向水体中先投放生石灰,后投放纯碱,理由是过量的钙离子可通过纯碱使之沉淀下来.
(3)次氯酸的强氧化性能杀死水体中的病菌,但不能直接用次氯酸为自来水消毒,这时因为次氯酸易分解,且毒性较大.已知:Cl2+H2O?HCl+HClO K=4.5×10-6,使用氯气为自来水消毒可以有效地控制次氯酸的浓度,请结合信息解释:使用Cl2为自来水消毒的理由:由氯气与水反应的平衡常数可知,该反应的限度很小,生成的HClO浓度很小,且随着HClO的消耗,平衡会不断向正反应移动,补充HClO.下列物质中,可以代替氯气用作自来水消毒剂的是①③(填写序号).
①臭氧 ②酒精 ③K2FeO4 ④SO2.
分析 (1)常用混凝剂为FeSO4•7H2O,被氧化、水解后生成Fe(OH)3,具有吸附作用,可除去水中的悬浮物;
(2)除去Ca2+、Mg2+,应先加入石灰,然后加入纯碱,可除去过量的钙离子;
(3)由氯气与水反应的平衡常数K=4.5×10-6可知,该反应的限度很小,生成的HClO浓度很小,而反应是可逆反应,次氯酸消耗平衡正向移动,所以可以有效地控制次氯酸的浓度;臭氧和K2FeO4有强氧化性,可用作饮用水的消毒剂.
解答 解:(1)常用混凝剂为FeSO4•7H2O,被氧化、水解后生成Fe(OH)3,具有吸附作用,可除去水中的悬浮物,所以混凝剂除去杂质的过程中既有化学变化也有物理变化,亚铁离子被氧化的离子反应为:4Fe2++O2+10H2O=4Fe(OH)3+8H+,故答案为:③;Fe(OH)3;4Fe2++O2+10H2O=4Fe(OH)3+8H+;
(2)除去Ca2+、Mg2+,应先加入石灰,然后加入纯碱,过量的钙离子可通过纯碱使之沉淀下来,故答案为:生石灰;纯碱;过量的钙离子可通过纯碱使之沉淀下来;
(3)由氯气与水反应的平衡常数K=4.5×10-6可知,该反应的限度很小,生成的HClO浓度很小,而反应是可逆反应,次氯酸消耗平衡正向移动,所以可以有效地控制次氯酸的浓度,臭氧和K2FeO4有强氧化性,可用作饮用水的消毒剂,故答案为:由氯气与水反应的平衡常数可知,该反应的限度很小,生成的HClO浓度很小,且随着HClO的消耗,平衡会不断向正反应移动,补充HClO;①③.
点评 本题考查物质的分离和提纯,题目难度不大,注意常用混凝剂为FeSO4•7H2O,被氧化、水解后生成Fe(OH)3.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.以下不属于化学键的是( )
| A. | 离子键 | B. | 共价键 | C. | 金属键 | D. | 分子间力 |
17.下列物质的水溶液因水解呈碱性的是( )
| A. | NaOH | B. | CH3COONa | C. | NH4Cl | D. | NaHSO4 |
14.下列说法错误的是( )
| A. | 液氨汽化时要吸收大量的热,常用作制冷剂 | |
| B. | 压减燃煤、严格控车、调整产业是治理雾霾的有效措施 | |
| C. | 手机外壳上贴的碳纤维外膜是一种新型的无机非金属材料 | |
| D. | 铝及其合金是电气、工业、家庭广泛使用的材料,是因为铝比铁更耐酸碱的腐蚀 |
16.18g碳单质与标准状况下22.4L O2反应放出热量是Q1kJ,已知由碳单质生成1mol CO2气体放热Q2 kJ.下列说法不正确的是( )
| A. | 由碳燃烧生成CO的热化学方程式是C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=(Q1-0.5Q2)kJ/mol | |
| B. | 由碳燃烧生成1mol CO放出的热量是(Q1-0.5Q2)kJ | |
| C. | 由碳燃烧生成CO的热化学方程式是2C(s)+O2(g)═2CO(g)△H=(Q2-2Q1)kJ/mol | |
| D. | 碳和CO2反应的热化学方程式是C(s)+CO2(g)═2CO(g)△H=(2Q2-2Q1)kJ/mol |
 A、B、C、D、E 分别代表中学化学中的常见物质,请根据题目要求回答下列问题:
A、B、C、D、E 分别代表中学化学中的常见物质,请根据题目要求回答下列问题: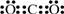 .
.
 ,其单质的电子式为
,其单质的电子式为 ;
;