题目内容
17.下列物质的水溶液因水解呈碱性的是( )| A. | NaOH | B. | CH3COONa | C. | NH4Cl | D. | NaHSO4 |
分析 物质的水溶液因水解呈碱性的是强碱弱酸盐,据此分析.
解答 解:A、NaOH是强碱,在水中能电离出大量的氢氧根,故是电离显碱性,故A错误;
B、醋酸钠是强碱弱酸盐,故水解显碱性,故B正确;
C、氯化铵是强酸弱碱盐,在溶液中水解显酸性,故C错误;
D、硫酸氢钠是强酸强碱盐,在溶液中能电离为钠离子、氢离子和硫酸根,故是电离显酸性,故D错误.
故选B.
点评 本题考查了盐类的水解和电解质的电离,难度不大,应注意的是碱一定显碱性,但显碱性的不一定是碱.

练习册系列答案
相关题目
8.CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示.下列说法不正确的是( )
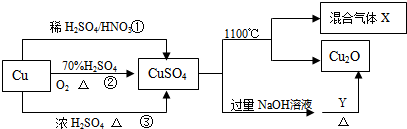

| A. | 将CuSO4溶液蒸发浓缩、冷却结晶可制得胆矾晶体 | |
| B. | 相对于途径①③,途径②更好地体现了绿色化学思想 | |
| C. | CuSO4在1100℃分解所得气体X可能是SO2和SO3的混合气体 | |
| D. | Y可能是葡萄糖 |
5.用下列装置进行相应的实验,装置正确且能达到实验目的是( )
| A. |  用图所示装置验证 NaHCO 3 的不稳定性 | |
| B. |  用图所示装置提取苯硝化反应后的产物 | |
| C. | 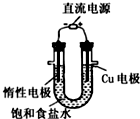 用图所示装置模拟氯碱工业生产氯气 | |
| D. | 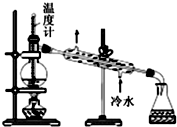 用图所示装置分馏石油 |
12.在1L溶液中含有Fe(NO3)3和H2SO4两种溶质,其浓度分别为0.2mol/L和1.5mol/L,现向该溶液中加入39.2g铁粉使其充分反应.下列有关说法正确的是( )
| A. | 反应后溶液中Fe3+物质的量为0.8mol | |
| B. | 反应后产生13.44L H2(标准状况) | |
| C. | 反应后溶液中Fe2+和Fe3+物质的量之和为0.9mol | |
| D. | 由于氧化性Fe3+>H+,故反应中先没有气体产生后产生气体 |
9.NA为阿伏伽德罗常数,下列叙述正确的是( )
| A. | 25℃时,1LpH=13的Ba(OH)2溶液中含有的OH-数为0.2NA | |
| B. | 18gD2O中含有的质子数为9NA | |
| C. | Fe在少量Cl2中燃烧生成0.5mol产物,转移的电子数为NA | |
| D. | 标准状况下,11.2LCCl4含有的分子数为0.5NA |
7.某废水中含有下列离子中的5种(忽略水的电离及离子的水解),K+、Cu2+、Al3+、Fe2+、Cl-、CO32-、NO3-、SO42-,测得各种离子的物质的量浓度相等.为探究废水的组成,某同学进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃观察无紫色火焰.
②另取溶液加入足量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变.
③另取溶液加入BaCl2溶液,有白色沉淀生成.
根据上述实验,以下推测正确的是( )
①用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃观察无紫色火焰.
②另取溶液加入足量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变.
③另取溶液加入BaCl2溶液,有白色沉淀生成.
根据上述实验,以下推测正确的是( )
| A. | 溶液中无法确定Al3+的存在 | |
| B. | 原溶液中不含的离子为:K+、Cu2+、CO32- | |
| C. | 步骤②中可以确定存在Cl-、Fe2+、NO3- | |
| D. | 步骤③中共有2种钡盐沉淀生成 |