��Ŀ����
15���±�ΪԪ�����ڱ���һ���֣�����Ԫ�آ�-���ڱ��е�λ�ã��û�ѧ����ش��������⣮
��1��Ԫ�آڵ�ԭ�ӽṹʾ��ͼΪ
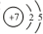 ���䵥�ʵĵ���ʽΪ
���䵥�ʵĵ���ʽΪ ��
����2���ܡ��ݡ����ԭ�Ӱ뾶�ɴ�С��˳��ΪNa��Cl��F����Ԫ�ط��ű�ʾ����
��3��������������ˮ������ݵ�����������ˮ���ﷴӦ�����ӷ���ʽΪAl��OH��3+OH-=AlO2-+2H2O��
��4���ȽϢ����ǽ����Ե�ǿ�����ߣ��ࣨ���������������=�������û�ѧ����ʽ����Ҫ����������˵����ԭ������ͨ�뵽������Һ�У��е���ɫ�������ɣ�Cl2+H2S=2HCl+S����
��5���ڵ���̬�⻯��ͨ������̬�⻯���ˮ��Һ�У���Ӧ��������Һ��pH��7�����������������=�������û�ѧ����ʽ�����ӷ���ʽ������ԭ��NH4Cl+H2O=HCl+NH3��H2O��
��6���١�������Ԫ�ذ�ԭ�Ӹ���1��1��ɵij���Һ̬�������������Һ���ܽ�Fe2+������д���÷�Ӧ�����ӷ���ʽH2O2+2Fe2++2H+=2Fe3++2H2O��
���� ��Ԫ�������ڱ��е�λ�ÿ�֪������H������N������O������F������Na������Al������S������Cl��
��1��N��ԭ������Ϊ7�������д���N��N��
��2�����Ӳ�Խ��뾶Խ���Ӳ���ͬʱ�˵����Խ��뾶ԽС��
��3��������������ˮ������ݵ�����������ˮ���ﷴӦ����ƫ�����ƺ�ˮ��
��4���ǽ�����Cl��S���������������⣻
��5���ڵ���̬�⻯��ͨ������̬�⻯���ˮ��Һ�У���Ӧ�����Ȼ�泥�ˮ�������ԣ�
��6���١�������Ԫ�ذ�ԭ�Ӹ���1��1��ɵij���Һ̬������ΪH2O2����������Һ���ܽ�Fe2+������
��� �⣺��Ԫ�������ڱ��е�λ�ÿ�֪������H������N������O������F������Na������Al������S������Cl��
��1��N��ԭ������Ϊ7����ԭ�ӽṹʾ��ͼΪ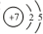 �������д���N��N�������ʽΪ
�������д���N��N�������ʽΪ ��
��
�ʴ�Ϊ��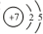 ��
�� ��
��
��2�����Ӳ�Խ��뾶Խ���Ӳ���ͬʱ�˵����Խ��뾶ԽС��ԭ�Ӱ뾶ΪNa��Cl��F��
�ʴ�Ϊ��Na��Cl��F��
��3��������������ˮ������ݵ�����������ˮ���ﷴӦ����ƫ�����ƺ�ˮ�����ӷ�ӦΪAl��OH��3+OH-=AlO2-+2H2O��
�ʴ�Ϊ��Al��OH��3+OH-=AlO2-+2H2O��
��4�������ǽ����Ե�ǿ�����ߣ��࣬�û�ѧ����ʽ����Ҫ����������˵����ԭ��Ϊ������ͨ�뵽������Һ�У��е���ɫ�������ɣ�Cl2+H2S=2HCl+S����
�ʴ�Ϊ������������ͨ�뵽������Һ�У��е���ɫ�������ɣ�Cl2+H2S=2HCl+S����
��5���ڵ���̬�⻯��ͨ������̬�⻯���ˮ��Һ�У���Ӧ�����Ȼ�泥�ˮ�������ԣ�pH��7��ˮ�ⷴӦΪNH4Cl+H2O=HCl+NH3��H2O��
�ʴ�Ϊ������NH4Cl+H2O=HCl+NH3��H2O��
��6���١�������Ԫ�ذ�ԭ�Ӹ���1��1��ɵij���Һ̬������ΪH2O2����������Һ���ܽ�Fe2+���������ӷ�ӦΪH2O2+2Fe2++2H+=2Fe3++2H2O��
�ʴ�Ϊ��H2O2+2Fe2++2H+=2Fe3++2H2O��
���� ���⿼��λ�á��ṹ�����ʵĹ�ϵ��Ϊ��Ƶ���㣬����Ԫ�ص�λ�á�Ԫ�ػ���������Ϊ���Ĺؼ������ط�����Ӧ�������Ŀ��飬ע��Ԫ�������ɵ�Ӧ�ã���Ŀ�ѶȲ���

| A�� |  ��ͼ��ʾװ����֤ NaHCO 3 �IJ��ȶ��� | |
| B�� | 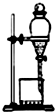 ��ͼ��ʾװ����ȡ��������Ӧ��IJ��� | |
| C�� | 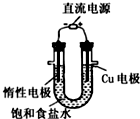 ��ͼ��ʾװ��ģ���ȼҵ�������� | |
| D�� | 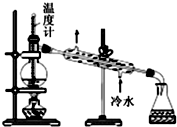 ��ͼ��ʾװ�÷���ʯ�� |
��ȡһ��������KCl��NaClO4���ܽ���ϣ�����ȴ�����ˡ��˳�����������ˮ���ϴ�Ӽ���ո���õ����й������ܽ�����¶ȵĹ�ϵ���±���
| �¶� �ܽ�� ��ѧʽ | 0�� | 10�� | 20�� | 30�� | 40�� |
| KClO4 | 0.76 | 1.06 | 1.68 | 2.56 | 3.73 |
| KCl | 28 | 31.2 | 34.2 | 37.2 | 40.1 |
| NaClO4 | 167 | 183 | 201 | 222 | 245 |
��2���ȵ����������������ʣ�������Դʹ���ܻ��������һ�δ�����أ�Li/FeS2�ȵ�ع���ʱ��Liת��Ϊ��ﮣ�FeS2ת��Ϊ�����õ�ع���ʱ������ܷ�ӦΪFeS2+4Li�TFe+2Li2S��
��3��Fe��KClO4��Ӧ�ų���������Ϊ�����ε���ṩ550-660����¶ȣ�ʹ���۵����ۻ����磬�Ӷ������أ��乩��ԭ��Ϊ��KClO4 ��s��+4Fe��s���TKCl ��s��+4FeO��s������H��0��
��600��ʱFeO�ɲ��ַֽ�����Fe3O4��д���йصĻ�ѧ����ʽ4FeO=Fe3O4+Fe��
�ڳ�ȡһ�������������Ȳ��Ϸ�Ӧ��Ļ����ٶ�ֻ���Ȼ���һ�ּ��Σ����ձ��У�������ˮ���ϴ�ӡ����ˡ������������������0.43g���ڹ����м������������ϡ���ᣬ�������ַ�Ӧ��������ȫ�ܽ�õ�����Һ�м��������NaOH��Һ�������ˡ�ϴ����������ڿ����г�����յ�6.0 g��ɫ���壮��ü��Ȳ��Ϸ�Ӧǰ����������ص���������д��������̣��������2λ��Ч���֣��ü��Ȳ��Ϸ�Ӧǰ��������ص������ֱ�Ϊ4.2g��0.80g��
| A�� | ��Һ�����塢��Һ���ڲ�ͬ�ķ�ɢϵ | |
| B�� | ������������ɢϵ�ı��������ǽ����ɢ������ֱ����1nm-100nm֮�� | |
| C�� | �����ö�������������Һ�ͽ��� | |
| D�� | ���ù��˵ķ������Է��뽺�����Һ |
���ò�˿պȡ������Һ���ڻ��������գ�����ɫ�ܲ����۲�����ɫ���森
����ȡ��Һ��������ϡ���ᣬ����ɫ�������ɣ�����ɫ������������ɺ���ɫ����ʱ��Һ��Ȼ���壬����Һ������������䣮
����ȡ��Һ����BaCl2��Һ���а�ɫ�������ɣ�
��������ʵ�飬�����Ʋ���ȷ���ǣ�������
| A�� | ��Һ����ȷ��Al3+�Ĵ��� | |
| B�� | ԭ��Һ�в���������Ϊ��K+��Cu2+��CO32- | |
| C�� | ������п���ȷ������Cl-��Fe2+��NO3- | |
| D�� | ������й���2�ֱ��γ������� |
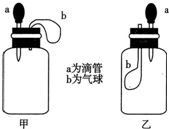 ��ͼ��ʾ����ѹ��ͷ�ιܣ�װ��Һ�壩a����Һ����뵽���ƿ��װ����һ�����ʣ��У���װ���е����ɱ�b�������Ե��ʹ���Һ������������Ӱ�죬�Լ������ƿ�������Ĵ���Ӱ�죩���������Լ��������ǣ�������
��ͼ��ʾ����ѹ��ͷ�ιܣ�װ��Һ�壩a����Һ����뵽���ƿ��װ����һ�����ʣ��У���װ���е����ɱ�b�������Ե��ʹ���Һ������������Ӱ�죬�Լ������ƿ�������Ĵ���Ӱ�죩���������Լ��������ǣ�������| A�� | �ף�H2O��CaO�����壩���ң�H2O��NH4NO3�����壩 | |
| B�� | �ף������Na2O2�����壩���ң�����������Һ������ | |
| C�� | �ף�NaOH��Һ��CO2���ң������NaHCO3��Һ | |
| D�� | �ף�ŨH2SO4�����ǣ����壩���ң�H2O��NO2 |
| X | ||||||
| Y | Z | W |
| A�� | ��ҵ�ϵ��YW������Һұ������Y | |
| B�� | Y��W������������ˮ��������ܽ����Z | |
| C�� | ��̬�⻯����ȶ��ԣ�W��X | |
| D�� | �����Ӱ뾶�Ĵ�С˳��r��Y+����r��X-�� |