题目内容
3.现行的长式周期表,由左到右为18列,碱金属族为第1列,稀有气体为第18列.按这个规定,下列说法中错误的是( )| A. | 过渡元素包括七个副族和第Ⅷ族的元素 | |
| B. | 第3列中元素种类最多 | |
| C. | 第17列的第一种元素对应最高价氧化物的水化物是最强的含氧酸 | |
| D. | 第15列元素的氢化物组成通式可用RH3表示 |
分析 由左到右为18列,碱金属族为第1列,稀有气体为第18列,则第3列为第ⅢB族,17列为卤族元素,15列为氮族元素,以此来解答.
解答 解:A.过渡元素包括七个副族和第Ⅷ族的元素,为周期表中第3~12列,均为金属元素,故A正确;
B.第3列中含锕系和镧系,元素种类最多,故B正确;
C.第17列的第一种元素为F,无正价,故C错误;
D.第15列元素的氢化物中氮族元素的最低价为-3价,则组成通式可用RH3表示,故D正确;
故选C.
点评 本题考查元素周期表的结构及应用,为高频考点,把握周期表中族与列的关系、元素的位置为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.短周期元素R、W、X、Y、Z的原子序数依次增大,R原子的最外层电子数是其内层电子数的2倍,X 元素的焰色反应呈黄色,W元素和Z元素同主族,且Z元素的核电荷数是W的2倍,Y是地壳中除氧外含量最多的非金属元素.下列说法不正确的是( )
| A. | W与X形成的两种化合物中阴、阳离子的个数比均为1:2 | |
| B. | Y、R、Z最高价氧化物对应水化物的酸性强弱顺序:Z>R>Y | |
| C. | W的简单氢化物稳定性比Z的简单氢化物稳定性低 | |
| D. | Y与W形成的化合物YW2的熔点高、硬度大 |
14.A,B均为短周期元素,已知A元素原子的最外层电子数为a,次外层电子数为b; B元素原了的M 层电子数为(a-b),L层电子数为(a+b),则A、B所形成的化合物的性质可能有( )
| A. | 能与水反应 | B. | 能与NaOH溶液反应 | ||
| C. | 能与稀硫酸反应 | D. | 在空气中能燃烧 |
12.下列叙述中一定能说明A的金属性比B强的是( )
| A. | A原子的最外层电子数比B原子的最外层电子数少 | |
| B. | 常温时,A能从盐酸中置换出氢气,而B不能反应 | |
| C. | B不能从溶液中置换出A | |
| D. | 1 mol A失去的电子比1 mol B失去的电子多 |
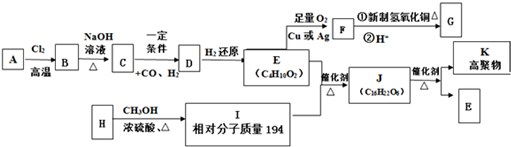
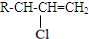
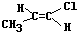 .
.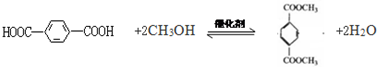 .
.

 .过量该物质与偏铝酸钠溶液反应的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
.过量该物质与偏铝酸钠溶液反应的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
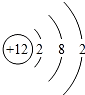 ,⑧
,⑧