题目内容
1.下列物质中,不能通过单质直接化合生成的是( )| A. | HCl | B. | MgO | C. | SO3 | D. | CO2 |
分析 A.氢气和氯气在点燃或光照条件下可生成氯化氢;
B.镁与氧气点燃生成氧化镁;
C.硫单质和氧气反应只能生成二氧化硫;
D.碳与氧气反应生成二氧化碳.
解答 解:A.氢气和氯气在点燃或光照条件下可生成氯化氢,能通过单质直接化合生成,故A正确;
B.镁与氧气点燃生成氧化镁,能通过单质直接化合生成,故B正确;
C.无论S是否过量,S在氧气中燃烧都生成SO2,故C错误;
D.碳与氧气反应生成二氧化碳,能通过单质直接化合生成,故D正确.
故选C.
点评 本题考查物质之间的反应,明确物质的性质是解本题关键,掌握物质性质和反应条件是解题关键,题目难度不大.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
12.已知相同温度下CH3COOH和NH3•H2O的电离常数相等,现向10mL浓度为0.1mol•L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
| A. | 水的电离程度始终增大 | |
| B. | c(NH4+):c(NH3•H2O)始终减小 | |
| C. | c(CH3COOH)与c(CH3COO?)之和始终保持不变 | |
| D. | 当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO-) |
9.在一定条件下,2N02?N204正反应放热,达到平衡,下列说法正确的是( )
| A. | 在密闭定容体系中降温,混合气颜色变浅,体系压强增大 | |
| B. | 只降温,混合气体颜色变浅,说明正反应是放热的 | |
| C. | 加压时,混合气颜色开始变浅,后来又逐渐加深 | |
| D. | 加压时,混合气颜色开始变深,后来又逐渐变浅 |
6.下列溶液中,Cl-离子浓度最大的是( )
| A. | 0.5mol•L-1HCl溶液 | B. | 1mol•L-1MgCl2溶液 | ||
| C. | 2mol•L-1NaCl溶液 | D. | 1mol•L-1FeCl3溶液 |
13.如表是甲同学研究氯水性质实验片段的活动记录.
(1)根据上述实验内容和现象,选择合理解释填到表中(填序号)
A.氯化中存在Cl-
B.氯水中有漂白性物质和酸性物质
C.氯水中存在Cl2分子
(2)甲同学在实验中运用了AD进行探究(填序号)
A.观察法 B.比较法 C.分类法 D.实验法
(3)乙同学在甲同学的实验基础上设计了如图实验装置进一步研究氯气的性质.
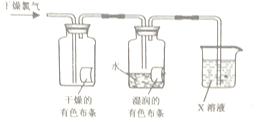
回答下列问题:
①实验中,乙同学观察到干燥的有色布条不褪色,湿润的有色布条褪色,得出的实验结论是干燥氯气没有漂白性.
②为了防止多余的氯气污染空气,实验室常用X溶液来吸收尾气,写出X的化学式NaOH.
| 实验内容 | 实验现象 | 解释及结论 |
| 观察氯水的颜色、状态 | 呈黄绿色 | ① C |
| 向氯水中滴入几滴硝酸银溶液 | 有白色沉淀 | ② A |
| 用玻璃棒蘸取氯水,点在蓝色石蕊试纸上 | 滴有氯水的试纸中间变白,外圈变红 | ③ B |
A.氯化中存在Cl-
B.氯水中有漂白性物质和酸性物质
C.氯水中存在Cl2分子
(2)甲同学在实验中运用了AD进行探究(填序号)
A.观察法 B.比较法 C.分类法 D.实验法
(3)乙同学在甲同学的实验基础上设计了如图实验装置进一步研究氯气的性质.

回答下列问题:
①实验中,乙同学观察到干燥的有色布条不褪色,湿润的有色布条褪色,得出的实验结论是干燥氯气没有漂白性.
②为了防止多余的氯气污染空气,实验室常用X溶液来吸收尾气,写出X的化学式NaOH.
10.想下列溶液中,各组离子一定能够大量共存的是( )
| A. | 能使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe2+ | |
| B. | 能使紫色石蕊试液变红的溶液:Fe2+、Mg2+、MnO4-、Cl- | |
| C. | 常温pH<7的溶液K+、Ba2+、Cl-、Br- | |
| D. | 碳酸氢钠溶液K+、SO42-、Cl-、H+ |
11.关于有机物的下列说法中,正确的是( )
| A. | 所有醇和卤代烃都能发生消去反应 | |
| B. | 甲苯能使溴水因化学反应褪色而苯不能 | |
| C. | 苯酚在70℃水中溶解度不大 | |
| D. | 低级酯的密度一般小于水 |