题目内容
1.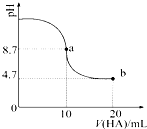 室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的
室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )
| A. | a点所示溶液中c(HA)>c(A-) | |
| B. | a点所示溶液中c(Na+)=c(A-)+c(HA) | |
| C. | 当加入HA溶液10mL时,c(OH-)<1.0×10-7mol•L-1 | |
| D. | b点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) |
分析 a点时溶质为NaA,盐的水解程度较小,则c(A-)>c(HA),根据物料守恒可得:c(Na+)=c(A-)+c(HA);加入10mLHA溶液时溶质为NaA,A-部分水解,溶液呈碱性,则c(OH-)>1.0×10-7mol•L-1;b点溶质为等浓度的HA和NaA,HA的电离程度大于A-的水解程度,混合液呈酸性,则c(A-)>c(HA),结合物料守恒可知c(A-)>c(Na+)>c(HA),据此进行解答.
解答 解:A.a点时加入10mLHA,两溶液恰好反应溶质为NaA,由于盐的水解程度较小,则c(A-)>c(HA),故A错误;
B.a点时溶质为NaA,根据物料守恒可得:c(Na+)=c(A-)+c(HA),故B正确;
C.加入10mLHA溶液时溶质为NaA,A-部分水解,溶液呈碱性,则c(OH-)>1.0×10-7mol•L-1,故C错误;
D.b点时的溶质为等浓度的HA和NaA,HA的电离程度大于A-的水解程度,混合液呈酸性,则c(A-)>c(HA),结合物料守恒可知:c(A-)>c(Na+)>c(HA),则正确的离子浓度大小为:c(A-)>c(Na+)>c(HA)>c(H+),故D错误;
故选B.
点评 本题考查了溶液酸碱性与溶液pH的计算与判断,题目难度中等,明确图象曲线对应溶质为解答关键,注意掌握溶液酸碱性与溶液pH的关系为能够根据电荷守恒、物料守恒等知识正确判断各离子浓度大小.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
11.在一定条件下,将3mol A和1mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?xC(g)+2D(g).2min后该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol/L,下列判断错误的是( )
| A. | x=1 | |
| B. | 2 min内A的反应速率为0.3 mol/(L•min) | |
| C. | B的转化率为40% | |
| D. | 若混合气体的密度不变,则表明该反应达到平衡状态 |
12.下列实验不能用如图所示装置实现的是( )
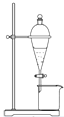

| A. | 用CCl4提取碘水中的碘 | |
| B. | 用水去除硬脂酸钠中的甘油 | |
| C. | 用NaOH溶液除去溴苯中的溴 | |
| D. | 用饱和Na2CO3溶液除去乙酸乙酯中的乙酸 |
16.1L 0.1mol/L AgNO3溶液在以Ag作阳极,Fe作阴极的电解槽中电解,当阴极上增重2.16g时,下列判断中正确的是( )
| A. | 溶液的浓度变为0.08mol/L | B. | 阳极上产生112ml O2 (标准状况) | ||
| C. | 转移的电子数是1.204×1022 个 | D. | 反应中有0.01mol Ag 被氧化 |
6.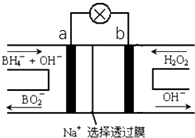 硼氢化物NaBH4(B元素的化合价为+3价)燃料电池(DBFC),由于具有比能量高、产物清洁无污染和燃料易于储存和运输等优点,被认为是一种很有发展潜力的燃料电池,其工作原理如图所示,下列说法正确的是( )
硼氢化物NaBH4(B元素的化合价为+3价)燃料电池(DBFC),由于具有比能量高、产物清洁无污染和燃料易于储存和运输等优点,被认为是一种很有发展潜力的燃料电池,其工作原理如图所示,下列说法正确的是( )
 硼氢化物NaBH4(B元素的化合价为+3价)燃料电池(DBFC),由于具有比能量高、产物清洁无污染和燃料易于储存和运输等优点,被认为是一种很有发展潜力的燃料电池,其工作原理如图所示,下列说法正确的是( )
硼氢化物NaBH4(B元素的化合价为+3价)燃料电池(DBFC),由于具有比能量高、产物清洁无污染和燃料易于储存和运输等优点,被认为是一种很有发展潜力的燃料电池,其工作原理如图所示,下列说法正确的是( )| A. | 放电时,每转移2mol电子,理论上需要消耗9.5gNaBH4 | |
| B. | 电极a采用MnO2,MnO2既作电极材料又有催化作用 | |
| C. | 电池放电时Na+从b极区移向a极区 | |
| D. | 电池的负极反应为BH4-+2H2O-8e-═BO2-+8H+ |
13.下列过程不涉及氧化还原反应的是( )
| A. | 古代用铜矿石、锡矿石冶炼铸造青铜器 | |
| B. | 出土后的青铜器大多数已受到锈蚀 | |
| C. | 古代用明矾溶液清除青铜镜表面的锈斑 | |
| D. | 现代用双氧水去除青铜器上有害的CuCl |




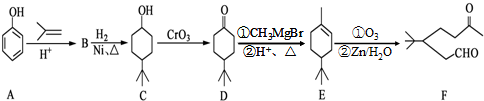
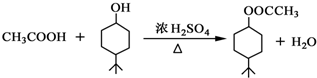 .
.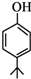 .同时满足下列条件的B的同分异构体(不包括B)共有11种:
.同时满足下列条件的B的同分异构体(不包括B)共有11种: )和烃W为主要原料制备有机物3-乙基-1,6-已二酸的合成路线
)和烃W为主要原料制备有机物3-乙基-1,6-已二酸的合成路线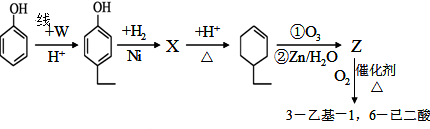
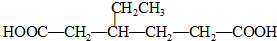
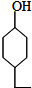 ,Z:
,Z: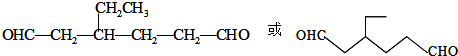 ;
;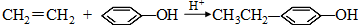 .
.