题目内容
11.在一定条件下,将3mol A和1mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?xC(g)+2D(g).2min后该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol/L,下列判断错误的是( )| A. | x=1 | |
| B. | 2 min内A的反应速率为0.3 mol/(L•min) | |
| C. | B的转化率为40% | |
| D. | 若混合气体的密度不变,则表明该反应达到平衡状态 |
分析 A.根据n=cV计算生成C的物质的量,结合D的物质的量,利用物质的量之比等于化学计量数之比计算x的值;
B.根据v=$\frac{\frac{△n}{V}}{△t}$计算v(D),再利用速率之比等于化学计量数之比计算v(A);
C.根据生成的D的物质的量,利用物质的量之比等于化学计量数之比计算参加反应的B的物质的量,再利用转化率定义计算;
D.容器的容积不变,混合气体的质量不变,密度为定值,始终不变.
解答 解:A.平衡时生成的C的物质的量为0.2mol•L-1×2L=0.4mol,物质的量之比等于化学计量数之比,故0.4mol:0.8mol=x:2,解得x=1,故A正确;
B.2min内生成0.8mol D,故2 min内D的反应速率v(D)=$\frac{\frac{0.8mol}{2L}}{2min}$=0.2 mol•(L•min)-1,速率之比等于化学计量数之比,故v(A)=$\frac{3}{2}$v(D)=$\frac{3}{2}$×0.2 mol•(L•min)-1=0.3 mol•(L•min)-1,故B正确;
C.2min末该反应达到平衡,生成0.8mol D,由方程式3A(g)+B(g)?xC(g)+2D(g)可知,参加反应的B的物质的量为:0.8mol×$\frac{1}{2}$=0.4mol,故B的转化率为$\frac{0.4mol}{1mol}$=100%=40%,故C正确;
D.容器的容积不变,混合气体的质量不变,密度为定值,始终不变,故混合气体的密度不变,不能说明反应达到平衡状态,故D错误;
故选D.
点评 本题考查化学平衡的有关计算、反应速率的有关计算、平衡状态的判断等知识,题目难度中等,注意掌握平衡状态的特征及三段式列式计算是解题的基本方法,试题培养了学生的分析能力及化学计算能力.

 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案| A. | ②①③ | B. | ②③① | C. | ③①② | D. | ③②① |
| A. | 用过滤的方法分离溶液和胶体 | |
| B. | 用四氯化碳萃取碘水中的碘 | |
| C. | 用蒸馏的方法将自来水制成蒸馏水 | |
| D. | 用加热的方法分离氯化钠和单质碘固体 |
| A. | 金属钠存放在试剂瓶中的煤油里 | |
| B. | 存放液溴的试剂瓶中应加水封 | |
| C. | 硝酸应用棕色瓶盛装且避光存放 | |
| D. | 烧碱应盛放在玻璃塞的磨口玻璃瓶中 |
| A. | 反应中共消耗1.75 mol H2SO4 | B. | 气体甲中SO2与H2的体积比为1:4 | ||
| C. | 反应中共消耗65 g Zn | D. | 反应中共转移3.6 mol电子 |

| A. | 通空气时,铜被腐蚀,表面产生CuO | |
| B. | 放电时,Li+透过固体电解质向Cu极移动 | |
| C. | 放电时,正极的电极反应式为Cu2O+H2O+2e-═2Cu+2OH- | |
| D. | 整个反应过程中,铜相当于催化剂 |
| A. | △H<0、△S>0的反应在任何温度下都能自发进行 | |
| B. | NH4HCO3(s)═NH3 (g)+H2O(g)+CO2(g)△H=+185.57 kJ•mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| C. | 硝酸铵固体的溶解过程与焓变有关 | |
| D. | 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的速率 |
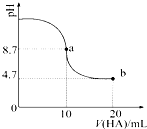 室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的
室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )
| A. | a点所示溶液中c(HA)>c(A-) | |
| B. | a点所示溶液中c(Na+)=c(A-)+c(HA) | |
| C. | 当加入HA溶液10mL时,c(OH-)<1.0×10-7mol•L-1 | |
| D. | b点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) |