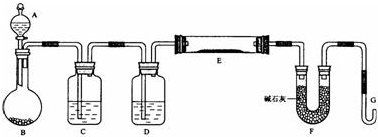
题目内容
9.对于可逆反应:A2(g)+3B2(g)?4C(g)△H<0,下列图象中正确的是( )| A. |  | B. |  | C. |  | D. |  |
分析 对于可逆反应A2(g)+3B2(g)?4C(g)△H<0,正反应放热,升高温度正逆反应速率都增大,化学向逆反应方向移动;该反应前后气体体积不变,则压强不影响平衡;然后结合“定一议二”“先拐先平”等知识对各选项进行判断.
解答 解:A.升高温度,正逆反应速率都增大,平衡向逆反应方向移动,交叉点后,逆反应速率应该大于正反应速率,故A正确;
B.该反应是气体体积不变的可逆反应,增大压强,平衡不移动,所以A的含量不变,与图象变化不一致,故B错误;
C.该反应是放热反应,先拐先平温度高,图象变化与实际不相符,故C错误;
D.压强越大,反应速率越大,但正逆反应速率仍然相等,平衡不移动,故D错误;
故选A.
点评 本题考查化学平衡的图象,题目难度中等,明确外界条件对化学平衡的影响及图象中纵横坐标的含义、“定一议二”“先拐先平”即可解答,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
19.下来有关物质分离方法的叙述中,不正确的是( )
| A. | 用过滤的方法分离溶液和胶体 | |
| B. | 用四氯化碳萃取碘水中的碘 | |
| C. | 用蒸馏的方法将自来水制成蒸馏水 | |
| D. | 用加热的方法分离氯化钠和单质碘固体 |
20.下列说法不正确的是( )
| A. | △H<0、△S>0的反应在任何温度下都能自发进行 | |
| B. | NH4HCO3(s)═NH3 (g)+H2O(g)+CO2(g)△H=+185.57 kJ•mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| C. | 硝酸铵固体的溶解过程与焓变有关 | |
| D. | 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的速率 |
17.下列关于有机化合物的说法正确的是( )
| A. | 可用纤维素的水解产物制取乙醇 | |
| B. | 己烷(C6H14)有四种同分异构体 | |
| C. | 乙烯、聚氯乙烯和苯分子中均含有碳碳双键 | |
| D. | 糖类、油脂和蛋白质均可发生水解反应 |
1.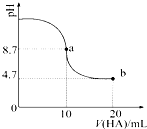 室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的
室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的
变化曲线如图所示.下列说法正确的是( )
 室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的
室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )
| A. | a点所示溶液中c(HA)>c(A-) | |
| B. | a点所示溶液中c(Na+)=c(A-)+c(HA) | |
| C. | 当加入HA溶液10mL时,c(OH-)<1.0×10-7mol•L-1 | |
| D. | b点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) |
18.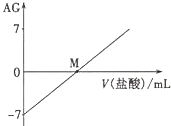 溶液的酸碱性可用酸度(AG)表示,AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$.室温下,将0.01mol•L-l盐酸逐滴滴人20.00mL 0.01 mol•L-l氨水中,溶液的AG变化如图所示.下列说法正确的是( )
溶液的酸碱性可用酸度(AG)表示,AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$.室温下,将0.01mol•L-l盐酸逐滴滴人20.00mL 0.01 mol•L-l氨水中,溶液的AG变化如图所示.下列说法正确的是( )
 溶液的酸碱性可用酸度(AG)表示,AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$.室温下,将0.01mol•L-l盐酸逐滴滴人20.00mL 0.01 mol•L-l氨水中,溶液的AG变化如图所示.下列说法正确的是( )
溶液的酸碱性可用酸度(AG)表示,AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$.室温下,将0.01mol•L-l盐酸逐滴滴人20.00mL 0.01 mol•L-l氨水中,溶液的AG变化如图所示.下列说法正确的是( )| A. | 室温下,0.01 mol•L-l盐酸的AG=12 | B. | M点时溶液中:c(NH4+)=c(Cl-) | ||
| C. | M点加入盐酸的体积大于20.00 mL | D. | M点以后NH4+的水解程度逐渐增大 |
19.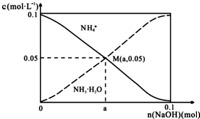 常温下,向1L0.1mol•L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H2O的变化趋势如图所示(不考虑体积变化和氨的挥发),下列说法正确的是( )
常温下,向1L0.1mol•L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H2O的变化趋势如图所示(不考虑体积变化和氨的挥发),下列说法正确的是( )
 常温下,向1L0.1mol•L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H2O的变化趋势如图所示(不考虑体积变化和氨的挥发),下列说法正确的是( )
常温下,向1L0.1mol•L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H2O的变化趋势如图所示(不考虑体积变化和氨的挥发),下列说法正确的是( )| A. | M点溶液中水的电离程度比原溶液大 | |
| B. | 在M点时,n(OH-)-n(H+)=(a-0.05)mol | |
| C. | 随着NaOH的加入,$\frac{c({H}^{+})}{c(N{H}_{4}^{+})}$不断增大 | |
| D. | 当n(NaOH)=0.05mol时溶液中有:c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+) |