题目内容
10.设NA为阿伏加德罗常数,下列说法中,错误的是( )| A. | 2.4g金属镁所含电子数目为0.2NA | |
| B. | 16gCH4所含原子数目为5NA | |
| C. | 17gNH3所含电子数目为10NA | |
| D. | 在常温常压下,11.2LN2含有的分子数为0.5NA |
分析 A、先求出镁的物质的量,然后根据1mol镁含12mol电子来计算;
B、先求出甲烷的物质的量,然后根据1molCH4含5mol原子来分析;
C、先求出氨气的物质的量,然后根据1molNH3含10mol电子来分析;
D.标准状况下气体摩尔体积为22.4L/mol.
解答 解:A、镁的物质的量n=$\frac{2.4g}{24g/mol}$=0.1mol,而1mol镁含12mol电子,故0.1mol电子含1.2mol电子,故A错误;
B、甲烷的物质的量n=$\frac{16g}{16g/mol}$=1mol,而1molCH4含5mol原子,故B正确;
C、氨气的物质的量n=$\frac{17g}{17g/mol}$=1mol,而1molNH3含10mol电子,故C正确;
D.在常温常压下,11.2L含物质的量不是0.5mol,故D错误;
故选AD.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,题目难度不大.

练习册系列答案
相关题目
3.下列实验操作及现象与实验结论一致的是( )
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入盐酸酸化的BaCl2溶液,生成白色沉淀 | 该溶液中不一定含有SO42- |
| B | 光洁的铁钉放在冷的浓硫酸中,无明显现象 | 铁钉与冷的浓硫酸不反应 |
| C | 将少量的溴水分别滴入FeCl2溶液、NaI溶液中,再分别滴加CCl4振荡静置,下层分别呈无色和紫红色 | 氧化性:Br2>Fe3+>I2 |
| D | 向浓度均为0.1mol•L-1的KCl、KI混合溶液中滴加1~2滴0.01mol•L-1的AgNO3溶液,产生的沉淀呈黄色 | Ksp(AgCl)<Ksp(AgI) |
| A. | A | B. | B | C. | C | D. | D |
18.下列说法正确的是( )
| A. | 淀粉、纤维素、油脂、蛋白质都属于天然高分子形成的混合物 | |
| B. | 葡萄糖溶液中加入新制Cu(OH)2悬浊液煮沸会析出红色沉淀 | |
| C. | 氨基酸有两性,其脱水缩合得到的蛋白质就不再有两性 | |
| D. | 纤维素、淀粉都可用(C6H10O5)n表示,但它们并不为同分异构体 |
5.下列有关化学用语的表述正确的是( )
| A. | 次氯酸的电子式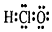 | B. | 二氧化硅的分子式:SiO2 | ||
| C. | 中子数为18的铝原子:1735Cl | D. | 钠离子的结构示意图: |
2.下列物质的水溶液能导电,但属于非电解质的是( )
| A. | HNO3 | B. | NaOH | C. | NH4NO3 | D. | CO2 |
19.以下转化不能通过一步反应实现的是( )
| A. | N2→NH3 | B. | Al2O3→Al(OH)3 | C. | Fe→FeCl2 | D. | SiO2→CaSiO3 |
 某研究性学习小组根据老师的学案设计实验对碳酸钠和碳酸氢钠的性质进行研究.
某研究性学习小组根据老师的学案设计实验对碳酸钠和碳酸氢钠的性质进行研究. 2C(g)+D(g),经2 min后,B的浓度减少了0.6 mol·L -1。对此反应速率的正确表示是( )
2C(g)+D(g),经2 min后,B的浓度减少了0.6 mol·L -1。对此反应速率的正确表示是( )