题目内容
15. 某研究性学习小组根据老师的学案设计实验对碳酸钠和碳酸氢钠的性质进行研究.
某研究性学习小组根据老师的学案设计实验对碳酸钠和碳酸氢钠的性质进行研究.(1)甲同学设计除去碳酸氢钠溶液中碳酸钠杂质的方法:向溶液中通入足量的二氧化碳.请写出相关反应的离子方程式CO32-+H2O+CO2=2HCO3-.
(2)乙同学设计如图实验装置,比较碳酸氢钠和碳酸钠的热稳定性,并检验分解产物.最好应在a试管底部加入Na2CO3(填化学式).
(3)小苏打长期放置在空气中会变质(部分转变为碳酸钠),丙同学称取27.4g变质小苏打样品,经过充分加热、冷却、称量,所得固体的质量为21.2g,则原混合物中碳酸钠的质量为10.6g.
分析 (1)碳酸钠溶液与二氧化碳反应生成碳酸氢钠,据此书写离子方程式;
(2)碳酸氢钠稳定性差,加热易分解,而碳酸钠稳定性较强,加热时难以分解,加热大试管时,a处温度较高,最好在a试管底部加入碳酸钠;
(3)发生反应为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,利用差量法计算出混合物碳酸氢钠的质量,然后计算出碳酸钠的质量.
解答 解:(1)碳酸氢钠与二氧化碳发生反应生成碳酸氢钠,反应的离子方程式为:CO32-+H2O+CO2=2HCO3-,
故答案为:CO32-+H2O+CO2=2HCO3-;
(2)碳酸氢钠在小试管b,Na2CO3在大使管a,大试管直接加热,温度较高,如温度较高的不分解,而加热温度较低的物质分解,可判断稳定强弱,
故答案为:Na2CO3;
(3)设混合物中含有碳酸氢钠的质量为x,
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑△m
168 62
x 27.4g-21.2g=6.2g
则:$\frac{168}{x}$=$\frac{62}{6.2g}$,
解得:x=16.8g,
原混合物中碳酸钠的质量为:27.4g-16.8g=10.6g,
答:原混合物中碳酸钠的质量是10.6g.
点评 本题考查物质检验与鉴别方案的设计,题目难度中等,明确碳酸钠、碳酸氢钠的性质为解答关键,注意掌握差量法的应用,试题培养了学生的分析能力及化学实验、化学计算能力.

练习册系列答案
相关题目
8.下列说法正确的是(NA表示阿伏加德罗常数的值)( )
①28g氮气所含有的原子数目为NA
②4g金属钙变成钙离子时失去的电子数目为0.1NA
③在常温常压下,11.2L N2含有的分子数为0.5NA
④在标况下 1mol Ne含有的原子数为NA
⑤0.5mol单质铝的质量为13.5g
⑥标准状况下,1L水所含分子数为$\frac{1}{22.4}$NA
⑦17g氨气所含电子数目为10NA.
①28g氮气所含有的原子数目为NA
②4g金属钙变成钙离子时失去的电子数目为0.1NA
③在常温常压下,11.2L N2含有的分子数为0.5NA
④在标况下 1mol Ne含有的原子数为NA
⑤0.5mol单质铝的质量为13.5g
⑥标准状况下,1L水所含分子数为$\frac{1}{22.4}$NA
⑦17g氨气所含电子数目为10NA.
| A. | ①②⑤⑥⑦ | B. | ①②④⑤⑥ | C. | ⑤⑦ | D. | ④⑤⑦ |
3.100mLMgCl2溶液中有Mg2+0.1mol,对该溶液的说法不正确的是( )
| A. | 该溶液的物质的量浓度为1mol•L-1 | |
| B. | 配置该溶液需用MgCl29.5g | |
| C. | 该溶液与200mL1mol•L-1NaCl溶液的Cl-的物质的量浓度相同 | |
| D. | 取10mL该溶液再稀至100mL,所得溶液的Cl-的物质的量为0.02mol |
10.设NA为阿伏加德罗常数,下列说法中,错误的是( )
| A. | 2.4g金属镁所含电子数目为0.2NA | |
| B. | 16gCH4所含原子数目为5NA | |
| C. | 17gNH3所含电子数目为10NA | |
| D. | 在常温常压下,11.2LN2含有的分子数为0.5NA |
20.唐代刘禹锡撰于818年的传信方中有这样一段描述“治气痢巴石丸,取白矾一大斤.以炭火净地烧令汁尽,则其色如雪,谓之巴石”.据此推测,用于治气痢巴石丸,其主要原料的化学成分为( )
| A. | CuSO4 | B. | FeSO4•7H2O | C. | KAl(SO4)2•7H2O | D. | Fe2(SO4)3•7H2O |
 .
.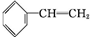 +Br2→
+Br2→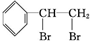 .
.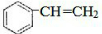 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$ .
. .请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式
.请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式 .
.
