题目内容
J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.
(1)M的离子结构示意图为 ;元素T在周期表中的位置 .
(2)J和氢组成的化合物分子中有14e-,其电子式为 .
(3)J、R、T形成的最简单的氢化物中最稳定的是 .(用化学式表示)
(4)L的最简单气态氢化物甲的水溶液显碱性.在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为 .
(5)由J、R形成的液态化合物JR2 0.2mol在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ.该反应的热化学方程式为 .
| J | ||||
| R |
(2)J和氢组成的化合物分子中有14e-,其电子式为
(3)J、R、T形成的最简单的氢化物中最稳定的是
(4)L的最简单气态氢化物甲的水溶液显碱性.在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为
(5)由J、R形成的液态化合物JR2 0.2mol在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ.该反应的热化学方程式为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:M是地壳中含量最多的金属元素,则M为Al元素;根据J、R在周期表中的相对位置可知,J位于第二周期、R位于第三周期;
J元素最低负化合价的绝对值与其原子最外层电子数相等,J的最外层含有4个电子,则J为C元素,根据R与J位置关系可知R为S元素;
T的原子序数大于S的,且为短周期主族元素,则T只能为Cl元素,
根据以上分析可知:J为C元素、M为Al元素、R为S元素、T为Cl元素.
J元素最低负化合价的绝对值与其原子最外层电子数相等,J的最外层含有4个电子,则J为C元素,根据R与J位置关系可知R为S元素;
T的原子序数大于S的,且为短周期主族元素,则T只能为Cl元素,
根据以上分析可知:J为C元素、M为Al元素、R为S元素、T为Cl元素.
解答:
解:M是地壳中含量最多的金属元素,则M为Al元素;根据J、R在周期表中的相对位置可知,J位于第二周期、R位于第三周期;J元素最低负化合价的绝对值与其原子最外层电子数相等,J的最外层含有4个电子,则J为C元素,根据R与J位置关系可知R为S元素;T的原子序数大于S的,且为短周期主族元素,则T只能为Cl元素,根据以上分析可知:J为C元素、M为Al元素、R为S元素、T为Cl元素,
(1)M为Al元素,铝离子的核电荷数为13,核外电子总数为10,铝离子结构示意图为: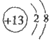 ;
;
T为Cl元素,核外电子层数为3,最外层含有7个电子,则Cl位于周期表中第三周期ⅦA族,
故答案为: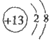 ; 第三周期ⅦA族;
; 第三周期ⅦA族;
(2)J为C元素,C和氢组成的化合物分子中有14e-,该化合物为乙炔,乙炔为共价化合物,其电子式为: ,
,
故答案为: ;
;
(3)J为C元素、R为S元素、T为Cl元素,金属性越强,其对应的气态氢化物越稳定,三种元素中非金属性最强的为Cl,则形成的最简单的氢化物中最稳定的是HCl,
故答案为:HCl;
(4)L的最简单气态氢化物甲的水溶液显碱性,则L为N元素,甲为氨气,该反应为氨气与双氧水的反应,由于反应的产物不污染环境,则反应生成了氮气和水,反应的化学方程式为:2NH3+H2O+3H2O2=N2↑+8H2O,
故答案为:2NH3+H2O+3H2O2=N2↑+8H2O;
(5)J为C元素、R为S元素,由J、R形成的液态化合物JR2为CS2,0.2mol CS2在O2中完全燃烧,生成两种气态氧化物为二氧化碳和二氧化硫,298K时放出热量215kJ,1molCS2在O2中完全燃烧放热的热量为:215kJ×
=1075kJ,
则该反应的热化学方程式为:CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ?mol-1,
故答案为:CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ?mol-1.
(1)M为Al元素,铝离子的核电荷数为13,核外电子总数为10,铝离子结构示意图为:
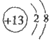 ;
;T为Cl元素,核外电子层数为3,最外层含有7个电子,则Cl位于周期表中第三周期ⅦA族,
故答案为:
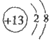 ; 第三周期ⅦA族;
; 第三周期ⅦA族; (2)J为C元素,C和氢组成的化合物分子中有14e-,该化合物为乙炔,乙炔为共价化合物,其电子式为:
 ,
,故答案为:
 ;
;(3)J为C元素、R为S元素、T为Cl元素,金属性越强,其对应的气态氢化物越稳定,三种元素中非金属性最强的为Cl,则形成的最简单的氢化物中最稳定的是HCl,
故答案为:HCl;
(4)L的最简单气态氢化物甲的水溶液显碱性,则L为N元素,甲为氨气,该反应为氨气与双氧水的反应,由于反应的产物不污染环境,则反应生成了氮气和水,反应的化学方程式为:2NH3+H2O+3H2O2=N2↑+8H2O,
故答案为:2NH3+H2O+3H2O2=N2↑+8H2O;
(5)J为C元素、R为S元素,由J、R形成的液态化合物JR2为CS2,0.2mol CS2在O2中完全燃烧,生成两种气态氧化物为二氧化碳和二氧化硫,298K时放出热量215kJ,1molCS2在O2中完全燃烧放热的热量为:215kJ×
| 1mol |
| 0.2mol |
则该反应的热化学方程式为:CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ?mol-1,
故答案为:CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ?mol-1.
点评:本题考查了位置结构与性质的关系及其应用,题目难度中等,正确推断元素名称为解答关键,注意掌握原子结构与元素周期表、元素周期律的关系,明确常见化学用语的书写原则,如:电子式、原子结构示意图、热化学方程式等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
元素周期表中铋元素的数据见右图,下列说法正确的是( )


| A、Bi元素的质量数是209 | ||||
B、H
| ||||
C、
| ||||
| D、原子序数为29的元素位于元素周期表的第四周期ⅠB族 |
下列溶液中氯离子的物质的量浓度与50mL 1mol/L的AlCl3溶液中氯离子的物质的量浓度相等的是( )
| A、75 mL 2 mol/L的CaCl2 |
| B、150 mL 3 mol/L的KCl |
| C、150 mL 1 mol/L的NaCl |
| D、75mL 2 mol/L的NH4Cl |
已知H2(g)+Cl2(g)=2HCl(g)△H=-92.3kJ?mol-1,则反应2HCl(g)=H2(g)+Cl2(g)的△H为( )
| A、+184.6kJ?mol-1 |
| B、-92.3kJ?mol-1 |
| C、-369.2kJ?mol-1 |
| D、+92.3kJ?mol- |
某元素X最高价含氧酸的分子量为98,且X的氢化物的分子式是H2X,则下列说法正确的是( )
| A、X的最高化合价为+4 |
| B、X是第三周期VA族元素 |
| C、X是第三周ⅥA族元素 |
| D、X的最高价含氧酸的分子式可表示为H2XO3 |
X、Y、W、R、T是前17号元素中的5种,X、Y位于同主族,Y原子的最外层电子数与次外层电子数相等,R原子的最外层电子数为次外层电子数的3倍,T无正价,W单质用于制造计算机芯片,下列说法不正确的是( )
| A、气态氢化物稳定性:W<T |
| B、离子半径:X<R |
| C、最高价氧化物对应水化物碱性:X>Y |
| D、Y单质能与冷水剧烈反应 |
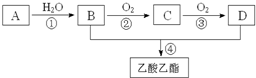 已知:A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平.现以A为主要原料合成乙酸乙酯,其合成路线如图所示.
已知:A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平.现以A为主要原料合成乙酸乙酯,其合成路线如图所示.