题目内容
7.下列说法或表示方法正确的是( )| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ | |
| C. | 由C(石墨)═C(金刚石)△H=1.90 kJ•mol-1可知,金刚石比石墨稳定 | |
| D. | 在100 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,则H2燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 |
分析 A、硫蒸气变化为硫固体为放热过程;
B.浓硫酸溶于水放热;
C.物质的能量越低越稳定;
D.2gH2完全燃烧生成液态水,放出285.8kJ热量,则1molH2完全燃烧生成液态水,放出285.8kJ热量.
解答 解:A、硫蒸气变化为硫固体为放热过程,则等量的硫蒸气和硫固体在氧气中分别完全燃烧,放出热量硫蒸气多,即前者放出热量多,故A错误;
B.在稀溶液中H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1,说明该中和反应中生成1mol液态水放出57.3kJ热量;由于浓硫酸溶于水放热,则将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3 kJ,故B正确;
C、由C(石墨)=C(金刚石);△H=+1.90 kJ/mol可知金刚石的能量比石墨的能量高,所以石墨比金刚石稳定,故C错误;
D、2gH2完全燃烧生成液态水,放出285.8kJ热量,则1molH2完全燃烧生成液态水,放出285.8kJ热量,所以氢气燃烧的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ/mol,故D错误.
故选B.
点评 本题考查了化学反应中的能量变化、中和热概念理解、反应自发性的判断等,属于基础知识的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.为除去氧化铁中的少量氧化铝,可选用的试剂是( )
| A. | 稀盐酸 | B. | 氢氧化钠溶液 | C. | 氨水 | D. | 铁粉 |
18.下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:(无特殊说明均填元素符号、化学式等化学用语)
(1)在⑤~⑨元素中,原子半径最小的是Cl,其离子的原子结构示意图为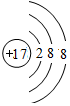 ,离子半径最大的是S 2-.
,离子半径最大的是S 2-.
(2)这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH.
(3)写出⑤和⑦的最高价氧化物对应水化物反应的离子方程式OH-+Al(OH)3=AlO2-+2H2O;
(4)按要求写出下列两种物质的电子式:②的氢化物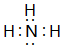 ;⑤的一种氧化物呈淡黄色,其含有的化学键类型有离子键和共价键,电子式为
;⑤的一种氧化物呈淡黄色,其含有的化学键类型有离子键和共价键,电子式为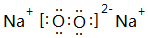 .
.
| 主族 周期 | IA | ⅡA | IIIA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
| 4 | ⑩ |
 ,离子半径最大的是S 2-.
,离子半径最大的是S 2-.(2)这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH.
(3)写出⑤和⑦的最高价氧化物对应水化物反应的离子方程式OH-+Al(OH)3=AlO2-+2H2O;
(4)按要求写出下列两种物质的电子式:②的氢化物
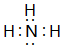 ;⑤的一种氧化物呈淡黄色,其含有的化学键类型有离子键和共价键,电子式为
;⑤的一种氧化物呈淡黄色,其含有的化学键类型有离子键和共价键,电子式为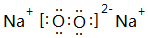 .
.
15.一定温度下,在3个体积均为1.0L的恒容密闭容器中反应2H2(g)+CO(g)?CH3OH(g)达到平衡,测得有关数据如表所示,下列说法正确的是( )
| 容器 | 温度/k | 物质的起始浓度/mol•L-1 | 物质的平衡浓度/mol•L-1 | ||
| c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
| Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
| Ⅱ | 400 | 0.40 | 0.20 | 0 | |
| Ⅲ | 500 | 0 | 0 | 0.10 | 0.025 |
| A. | 该方应的正反应吸热 | |
| B. | 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大 | |
| C. | 达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍 | |
| D. | 达到平衡时,容器Ⅲ中的反应速率比容器Ⅰ中的大 |
12.某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如图变化规律(图中P表示压强,T表示温度,n表示物质的量):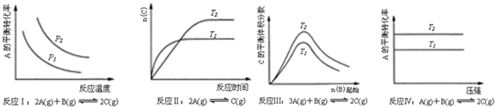
根据以上规律判断,下列结论正确的是( )

根据以上规律判断,下列结论正确的是( )
| A. | 反应Ⅰ:△H>0,P2>P1 | B. | 反应Ⅱ:△H<0,T1>T2 | ||
| C. | 反应Ⅲ:△H<0,T2>T1 | D. | 反应Ⅳ:△H<0,T2>T1 |
19. 到目前为止,由化学能转变的热能或电能仍然是人类使用最广泛的能源.
到目前为止,由化学能转变的热能或电能仍然是人类使用最广泛的能源.
(1)在25℃、101kPa下,16g的甲烷完全燃烧生成CO2和液态水时放出a kJ(a>0)的热量,则表示甲烷燃烧热的热化学方程式为CH4(g)+3O2(g)═CO2(g)+2H2O (l)△H=-2aKJ/mol.
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.
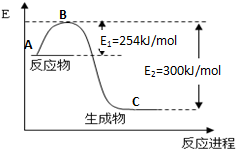
①图1是N2(g)和H2(g)发生反应生成1mol NH3(g)过程中的能量变化示意图,该反应过程是放热(填“放热”或“吸热”)过程,请写出生成2mol NH3的热化学方程式:N2(g)+3H2(g)=2NH3(g)△H=-92KJ/mol.
②已知:
试根据上表及图1中的数据计算N-H键的键能为390kJ/mol.
③若起始时向容器内放入1mol N2和3mol H2,10分钟后N2的转化率为15%,则该反应进行到此时共放出的热量为13.8kJ.
(3)①二氧化碳的捕集、利用是我国能源领域的一个重要研究方向.工业上用CO2和H2反应合成二甲醚.已知:
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1=-53.7kJ/mol
CH3OCH3(g)+H2O (g)═2CH3OH(g)△H2=+23.4kJ/mol
则:2CO2(g)+6H2(g)?CH3OCH3 (g)+3H2O(g)△H3=-130.8kJ/mol.
 到目前为止,由化学能转变的热能或电能仍然是人类使用最广泛的能源.
到目前为止,由化学能转变的热能或电能仍然是人类使用最广泛的能源.(1)在25℃、101kPa下,16g的甲烷完全燃烧生成CO2和液态水时放出a kJ(a>0)的热量,则表示甲烷燃烧热的热化学方程式为CH4(g)+3O2(g)═CO2(g)+2H2O (l)△H=-2aKJ/mol.
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.
①图1是N2(g)和H2(g)发生反应生成1mol NH3(g)过程中的能量变化示意图,该反应过程是放热(填“放热”或“吸热”)过程,请写出生成2mol NH3的热化学方程式:N2(g)+3H2(g)=2NH3(g)△H=-92KJ/mol.
②已知:
| 化学键 | H-H | N≡N |
| 键能(kJ/mol) | 435 | 943 |
③若起始时向容器内放入1mol N2和3mol H2,10分钟后N2的转化率为15%,则该反应进行到此时共放出的热量为13.8kJ.
(3)①二氧化碳的捕集、利用是我国能源领域的一个重要研究方向.工业上用CO2和H2反应合成二甲醚.已知:
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1=-53.7kJ/mol
CH3OCH3(g)+H2O (g)═2CH3OH(g)△H2=+23.4kJ/mol
则:2CO2(g)+6H2(g)?CH3OCH3 (g)+3H2O(g)△H3=-130.8kJ/mol.
16.某温度下,反应2A(g)?B(g)△H>0在密闭容器中达到平衡,平衡后$\frac{c(A)}{c(B)}$=a,若改变某一条件,足够时间后反应再次达到平衡状态,此时$\frac{c(A)}{c(B)}$=b,下列叙述正确的是( )
| A. | 若a=b,则容器中可能使用了催化剂或恒温恒容下充入惰性气体 | |
| B. | 在该温度下,保持容积固定不变,向容器内补充了B气体,则a<b | |
| C. | 若其他条件不变,升高温度,则a<b | |
| D. | 若保持温度、压强不变,充入惰性气体,则a>b |
17.对于反应CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,在其他条件不变的情况下( )
| A. | 改变压强,平衡不发生移动,反应放出的热量不变 | |
| B. | 加入催化剂,改变了反应的途径,反应的△H也随之改变 | |
| C. | 若在原电池中进行,反应放出的热量不变 | |
| D. | 升高温度,反应速率加快,反应放出的热量不变 |
 甲醇被称为2l世纪的新型燃料,工业上通过下列反应①和②,用CH4和H2O为原料来制备甲醇.
甲醇被称为2l世纪的新型燃料,工业上通过下列反应①和②,用CH4和H2O为原料来制备甲醇.