题目内容
9.下列有关化学用语正确的是( )| A. | NH4Cl的电子式: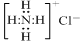 | |
| B. | 2-硝基甲苯的结构简式: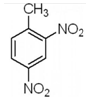 | |
| C. | 硫原子结构示意图: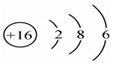 | |
| D. | 质子数为94、中子数为144的钚原子:${\;}_{94}^{144}$Pu |
分析 A、氯化铵是由氨根离子与氯离子通过离子键结合而成的离子化合物;
B、2-硝基甲苯是在甲苯苯环上的2号碳原子上连有一个硝基;
C、硫原子的核内有16个质子,核外有16个电子;
D、质量数=质子数+中子数.
解答 解:A、氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为: ,故A错误;
,故A错误;
B、2-硝基甲苯是在甲苯苯环上的2号碳原子上连有一个硝基,故结构简式为 ,故B错误;
,故B错误;
C、硫原子的核内有16个质子,核外有16个电子,故原子结构示意图为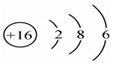 ,故C正确;
,故C正确;
D、质量数=质子数+中子数,故质子数为94、中子数为144的钚原子的质量数为238,即为23894Pu,故D错误.
故选C.
点评 本题考查了常见额化学用语,难度不大,应注意的是离子化合物电子式的书写方法.

练习册系列答案
相关题目
19.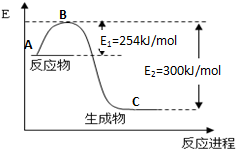 到目前为止,由化学能转变的热能或电能仍然是人类使用最广泛的能源.
到目前为止,由化学能转变的热能或电能仍然是人类使用最广泛的能源.
(1)在25℃、101kPa下,16g的甲烷完全燃烧生成CO2和液态水时放出a kJ(a>0)的热量,则表示甲烷燃烧热的热化学方程式为CH4(g)+3O2(g)═CO2(g)+2H2O (l)△H=-2aKJ/mol.
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.
①图1是N2(g)和H2(g)发生反应生成1mol NH3(g)过程中的能量变化示意图,该反应过程是放热(填“放热”或“吸热”)过程,请写出生成2mol NH3的热化学方程式:N2(g)+3H2(g)=2NH3(g)△H=-92KJ/mol.
②已知:
试根据上表及图1中的数据计算N-H键的键能为390kJ/mol.
③若起始时向容器内放入1mol N2和3mol H2,10分钟后N2的转化率为15%,则该反应进行到此时共放出的热量为13.8kJ.
(3)①二氧化碳的捕集、利用是我国能源领域的一个重要研究方向.工业上用CO2和H2反应合成二甲醚.已知:
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1=-53.7kJ/mol
CH3OCH3(g)+H2O (g)═2CH3OH(g)△H2=+23.4kJ/mol
则:2CO2(g)+6H2(g)?CH3OCH3 (g)+3H2O(g)△H3=-130.8kJ/mol.
 到目前为止,由化学能转变的热能或电能仍然是人类使用最广泛的能源.
到目前为止,由化学能转变的热能或电能仍然是人类使用最广泛的能源.(1)在25℃、101kPa下,16g的甲烷完全燃烧生成CO2和液态水时放出a kJ(a>0)的热量,则表示甲烷燃烧热的热化学方程式为CH4(g)+3O2(g)═CO2(g)+2H2O (l)△H=-2aKJ/mol.
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.
①图1是N2(g)和H2(g)发生反应生成1mol NH3(g)过程中的能量变化示意图,该反应过程是放热(填“放热”或“吸热”)过程,请写出生成2mol NH3的热化学方程式:N2(g)+3H2(g)=2NH3(g)△H=-92KJ/mol.
②已知:
| 化学键 | H-H | N≡N |
| 键能(kJ/mol) | 435 | 943 |
③若起始时向容器内放入1mol N2和3mol H2,10分钟后N2的转化率为15%,则该反应进行到此时共放出的热量为13.8kJ.
(3)①二氧化碳的捕集、利用是我国能源领域的一个重要研究方向.工业上用CO2和H2反应合成二甲醚.已知:
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1=-53.7kJ/mol
CH3OCH3(g)+H2O (g)═2CH3OH(g)△H2=+23.4kJ/mol
则:2CO2(g)+6H2(g)?CH3OCH3 (g)+3H2O(g)△H3=-130.8kJ/mol.
20.下列说法正确的是( )
| A. | 碳碳间以单键结合,碳原子剩余价键全部与氢原子结合的烃一定是饱和链烃 | |
| B. | 分子组成符合CnH2n+2的烃一定是烷烃 | |
| C. | 正戊烷分子中所有原子均在一条直线上 | |
| D. | CH3CH(CH3)2在光照下与氯气反应,可以生成四种一氯代烃 |
17.对于反应CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,在其他条件不变的情况下( )
| A. | 改变压强,平衡不发生移动,反应放出的热量不变 | |
| B. | 加入催化剂,改变了反应的途径,反应的△H也随之改变 | |
| C. | 若在原电池中进行,反应放出的热量不变 | |
| D. | 升高温度,反应速率加快,反应放出的热量不变 |
4.羟基的化学符号是( )
| A. | -NO2 | B. | -OH | C. | -COOH | D. | OH- |
14.下列说法正确的是( )
| A. | 2,2-二甲基-1-丁醇与2-甲基-2-丁醇互为同分异构体 | |
| B. |  的核磁共振氢谱有5个峰 的核磁共振氢谱有5个峰 | |
| C. | 根据核磁共振氢谱能鉴别1-溴丙烷和2-溴丙烷 | |
| D. | 用KMnO4酸性溶液能鉴别CH3CH═CHCH2OH和CH3CH2CH2CHO |
1.下列关于药物的使用说法正确的是( )
| A. | 虽然药物能治病,但大部份药物有毒副作用 | |
| B. | 青霉素有解热镇痛的作用 | |
| C. | 阿司匹林是最重要的抗生素 | |
| D. | 随着药物的普及,生病了都可以到药店自己买药吃,不用到医院 |
18.已知反应 3Cu+8HNO3(稀)═3Cu(NO3)2+2NO+4H2O,当转移3mol电子时,被还原的HNO3的物质的量为( )
| A. | 4mol | B. | 2mol | C. | 1mol | D. | 3mol |
12.以下是25℃时几种难溶电解质的溶解度:
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些离子.例如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可.
请回答下列问题:
(1)上述三个除杂方案都能够达到很好的效果,Fe2+、Fe3+都被转化为氢氧化铁(填名称)而除去.
(2)①中加入的试剂选择氨水为宜,其原因是不会引入新的杂质.
(3)②中除去Fe3+所发生的总反应的离子方程式为2Fe3+(aq)+3Mg(OH)2(s)═3Mg2+(aq)+2Fe(OH)3(s).
(4)下列与方案③相关的叙述中,正确的是ACD(填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.在pH>4的溶液中Fe3+一定不能大量存在
D.Cu2+可以大量存在于pH=4的溶液中.
| 难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可.
请回答下列问题:
(1)上述三个除杂方案都能够达到很好的效果,Fe2+、Fe3+都被转化为氢氧化铁(填名称)而除去.
(2)①中加入的试剂选择氨水为宜,其原因是不会引入新的杂质.
(3)②中除去Fe3+所发生的总反应的离子方程式为2Fe3+(aq)+3Mg(OH)2(s)═3Mg2+(aq)+2Fe(OH)3(s).
(4)下列与方案③相关的叙述中,正确的是ACD(填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.在pH>4的溶液中Fe3+一定不能大量存在
D.Cu2+可以大量存在于pH=4的溶液中.