题目内容
11.研究NO2、SO2、CO 等大气污染气体的处理具有重要意义.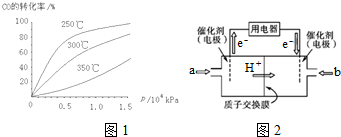
(1)NO2可用水吸收,相应的化学方程式为3NO2+H2O═2HNO3+NO.利用反应6NO2+8NH3 $?_{△}^{催化剂}$7N2+12H2O也可以处理NO2.当转移1.2mol电子时,消耗的NO2在标准状况下是67.2L.
(2)已知:
2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1
2NO (g)+O2(g)?2NO2(g)△H=-113.0kJ•mol-1
则反应NO2(g)+SO2(g)?SO3(g)+NO (g) 的△H=-41.8kJ•mol-1,一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是b.
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3与NO的体积比保持不变 d.每消耗1mol SO3的同时生成1mol NO2
测得上述反应平衡时的NO2与SO2体积比为1:6,则平衡常数K=$\frac{8}{3}$.
(3)CO可用于合成甲醇,反应方程式为CO (g)+2H2(g)?CH3OH (g).
①CO在不同温度下的平衡转化率与压强的关系如图1所示.该反应△H<0(填“>”或“<”).实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是在1.3×104kPa下,CO的转化率已较高,再增大压强CO的转化率提高不大,而生产成本增加得不偿失.
②甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图2所示:通入a气体的电极是原电池的负极(填“正”或“负”),其电极反应式为O2+4e-+4H+=2H2O.
分析 (1)根据物质与水的反应物与生成物来书写化学反应方程式,再利用氧化还原反应中电子转移计算,然后计算标准状况下气体的体积;
(2)根据盖斯定律来计算化学反应的焓变;根据化学平衡状态的特征:逆、定、动、变、等来判断化学反应是否达到平衡;化学平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变,计算平衡时各物质的浓度,可计算平衡常数;
(3)①从横坐标上一点,画一条平行于纵坐标的虚线,看相同压强下不同温度时CO的平衡转化率,温度越低转化率越低,说明,升温时平衡向逆向移动;
②根据图知,交换膜是质子交换膜,则电解质溶液呈酸性,根据氢离子移动方向知,通入a的电极为负极、通入b的电极为正极,负极上甲醇失去电子发生氧化反应,正极上是氧气得到电子发生还原反应,酸性溶液中生成水.
解答 解:(1)NO2与H2O反应的方程式为:3NO2+H2O═2HNO3+NO;6NO2+8NH3═7N2+12H2O,当反应中有1 mol NO2参加反应时,共转移了4 mol电子,故转移12mol电子时,消耗的NO2为12÷4×22.4L=67.2L,
故答案为:3NO2+H2O═2HNO3+NO;67.2;
(2)根据盖斯定律,将第二个方程式颠倒过来,与第一个方程式相加得:2NO2+2SO2═2SO3+2NO,△H=-83.6 kJ•mol-1,则NO2+SO2?SO3+NO△H=-41.8 kJ•mol-1;
a.本反应是反应前后气体分子数不变的反应,故体系的压强保持不变,故a不能说明反应已达到平衡状态,a错误;
b.随着反应的进行,NO2的浓度减小,颜色变浅,故b可以说明反应已达平衡,故b正确;
c.SO3和NO都是生成物,比例保持1:1,故c不能作为平衡状态的判断依据,故c错误;
d.d中所述的两个速率都是逆反应速率,不能作为平衡状态的判断依据,故d错误.
故选b;
NO2(g)+SO2(g)?SO3(g)+NO(g)
起始物质的体积 a 2a 0 0
转化物质的体积 x x x x
平衡物质的体积 a-x 2a-x x x
平衡时NO2与SO2体积比为1:6,即$\frac{a-x}{2a-x}$=$\frac{1}{6}$,故x=$\frac{4}{5}$a,故平衡常数K=$\frac{c(S{O}_{3})•c(NO)}{c(N{O}_{2})•c(S{O}_{2})}$=$\frac{{x}^{2}}{(a-x)(2a-x)}$=$\frac{(\frac{4}{5}a)^{2}}{\frac{1}{5}a×\frac{6}{5}a}$=$\frac{8}{3}$,
故答案为:-41.8;b;$\frac{8}{3}$;
(3)①从横坐标上一点0.5处,画一条平行于纵坐标的虚线,看相同压强下不同温度时CO的平衡转化率,温度越高转化率越低,说明,升温时平衡向逆向移动.
第二问:实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是工业生产要考虑速经济效益,要考虑速度和效率,压强越大需要的条件越高,花费越大.
故答案为:<;在1.3×104kPa下,CO的转化率已较高,再增大压强CO的转化率提高不大,而生产成本增加得不偿失;
②根据图知,交换膜是质子交换膜,则电解质溶液呈酸性,根据氢离子移动方向知,通入a的电极为负极、通入b的电极为正极,负极上甲醇失去电子发生氧化反应,负极反应式为 CH3OH-6e-+H2O=CO2+6H+,正极上氧气得电子发生还原反应,电极反应式为O2+4e-+4H+=2H2O,
故答案为:负;O2+4e-+4H+=2H2O.
点评 本题以NO2、SO2、CO等物质为载体,综合考查化学方程式的书写和氧化还原反应,及平衡常数的计算等问题,侧重于学生综合运用化学知识的能力的考查,题目难度中等.

(1)已知A和B为第三周期元素,其原子的第一至第四电离能如表所示:
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
(2)紫外光的光子所具有的能量约为399kJ•mol-1.根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因紫外光具有的能量比蛋白质分子中重要的化学键C-C、C-N和C-S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子.组成蛋白质的最简单的氨基酸中的碳原子杂化类型是sp2和sp3.
| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |

| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有12个.
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是CrO2.
(5)某配合物的分子结构如图2所示,其分子内不含有AC(填序号).
A.离子键 B.极性键 C.金属键
D.配位键 E.氢键 F.非极性键.
 到目前为止,由化学能转变的热能或电能仍然是人类使用最广泛的能源.
到目前为止,由化学能转变的热能或电能仍然是人类使用最广泛的能源.(1)在25℃、101kPa下,16g的甲烷完全燃烧生成CO2和液态水时放出a kJ(a>0)的热量,则表示甲烷燃烧热的热化学方程式为CH4(g)+3O2(g)═CO2(g)+2H2O (l)△H=-2aKJ/mol.
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.
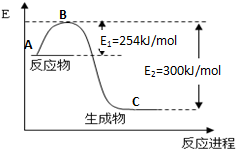
①图1是N2(g)和H2(g)发生反应生成1mol NH3(g)过程中的能量变化示意图,该反应过程是放热(填“放热”或“吸热”)过程,请写出生成2mol NH3的热化学方程式:N2(g)+3H2(g)=2NH3(g)△H=-92KJ/mol.
②已知:
| 化学键 | H-H | N≡N |
| 键能(kJ/mol) | 435 | 943 |
③若起始时向容器内放入1mol N2和3mol H2,10分钟后N2的转化率为15%,则该反应进行到此时共放出的热量为13.8kJ.
(3)①二氧化碳的捕集、利用是我国能源领域的一个重要研究方向.工业上用CO2和H2反应合成二甲醚.已知:
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1=-53.7kJ/mol
CH3OCH3(g)+H2O (g)═2CH3OH(g)△H2=+23.4kJ/mol
则:2CO2(g)+6H2(g)?CH3OCH3 (g)+3H2O(g)△H3=-130.8kJ/mol.
| A. | 若a=b,则容器中可能使用了催化剂或恒温恒容下充入惰性气体 | |
| B. | 在该温度下,保持容积固定不变,向容器内补充了B气体,则a<b | |
| C. | 若其他条件不变,升高温度,则a<b | |
| D. | 若保持温度、压强不变,充入惰性气体,则a>b |
| A. | △H>0,△S>0的反应在所有温度下都能自发进行 | |
| B. | NH4HCO3(s)=NH3 (g)+H2O(g)+CO2(g)△H=+185.57 kJ•mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| C. | △H<0、△S>0的反应在任何温度下都能自发进行 | |
| D. | 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应速率 |
| A. | 碳碳间以单键结合,碳原子剩余价键全部与氢原子结合的烃一定是饱和链烃 | |
| B. | 分子组成符合CnH2n+2的烃一定是烷烃 | |
| C. | 正戊烷分子中所有原子均在一条直线上 | |
| D. | CH3CH(CH3)2在光照下与氯气反应,可以生成四种一氯代烃 |
| A. | 虽然药物能治病,但大部份药物有毒副作用 | |
| B. | 青霉素有解热镇痛的作用 | |
| C. | 阿司匹林是最重要的抗生素 | |
| D. | 随着药物的普及,生病了都可以到药店自己买药吃,不用到医院 |
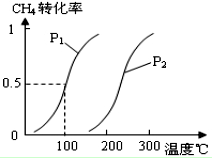 甲醇被称为2l世纪的新型燃料,工业上通过下列反应①和②,用CH4和H2O为原料来制备甲醇.
甲醇被称为2l世纪的新型燃料,工业上通过下列反应①和②,用CH4和H2O为原料来制备甲醇.