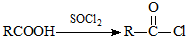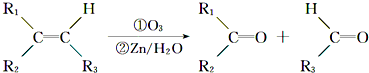题目内容
如图为五个椭圆交叉构成的图案,其中五个椭圆内分别写了C2H5OH、CO2、Fe2O3、FeCl3、KOH五种物质,图中相连的物质均可归为一类,相交部分A、B、C、D为相同的分类标准代号:
(1)相连的两种物质都是电解质的是 (填分类标准代号,下同),都是氧化物的是 .
(2)图中相连的两种物质能够相互反应的是 ,所属基本反应类型的是反应 .
(3)上述五种物质中的某一物质能与某种强酸反应生成上述中的另一种物质,则该反应的离子方程式为 .
(4)用洁净的烧杯取25ml蒸馏水,加热至沸腾,向烧杯中逐滴加入上述五种物质中的某一物质的饱和溶液,加热至液体呈红褐色,得到的分散系称为 ,证明该分散系生成的实验原理是 .
(5)在上述五种物质中,有一种物质(假设为甲)的水溶液遇到KSCN溶液变红,甲的化学式是
.
据此回答:已知甲能发生如下变化:甲
乙
甲,
①已知甲→乙反应的化学方程式: ;气体丙的化学式是 ,试写出反应乙→甲的离子方程式 .
②甲与铜粉发生反应的离子方程式 .

(1)相连的两种物质都是电解质的是
(2)图中相连的两种物质能够相互反应的是
(3)上述五种物质中的某一物质能与某种强酸反应生成上述中的另一种物质,则该反应的离子方程式为
(4)用洁净的烧杯取25ml蒸馏水,加热至沸腾,向烧杯中逐滴加入上述五种物质中的某一物质的饱和溶液,加热至液体呈红褐色,得到的分散系称为
(5)在上述五种物质中,有一种物质(假设为甲)的水溶液遇到KSCN溶液变红,甲的化学式是
据此回答:已知甲能发生如下变化:甲
| Fe |
| 气体丙 |
①已知甲→乙反应的化学方程式:
②甲与铜粉发生反应的离子方程式
考点:酸、碱、盐、氧化物的概念及其相互联系,分散系、胶体与溶液的概念及关系,化学基本反应类型,电解质与非电解质,铁盐和亚铁盐的相互转变
专题:
分析:(1)电解质:在水溶液中或熔融状态下能够导电的化合物;
非电解质:在熔融状态和水溶液中都不能导电的化合物;
氧化物:氧元素与另外一种化学元素组成的二元化合物;
(2)置换反应:指一种单质和一种化合物生成另一种单质和另一种化合物的反应;
分解反应:指一种化合物分解成二种或二种以上较简单的单质或化合物的反应;
化合反应:指的是由两种或两种以上的物质生成一种新物质的反应;
复分解反应:是由两种化合物互相交换成分,生成另外两种化合物的反应;
(3)C2H5OH、CO2与强酸不反应;Fe2O3与盐酸反应生成氯化铁和水;FeCl3与强酸不反应;KOH与盐酸反应生成氯化钾和水;
(4)根据氢氧化铁胶体的制备方法和胶体的性质进行判断;
(5)依据铁离子遇到硫氰酸钾溶液会生成血红色溶液,已知甲能发生如下变化:甲
乙
甲,为FeCl3
FeCL2
FeCL3;
①甲到乙是氯化铁和铁反应生成氯化亚铁;气体丙为氯气,乙到甲是氯气氧化亚铁离子生成铁离子;
②氯化铁溶液和铜反应生成氯化铜和氯化亚铁.
非电解质:在熔融状态和水溶液中都不能导电的化合物;
氧化物:氧元素与另外一种化学元素组成的二元化合物;
(2)置换反应:指一种单质和一种化合物生成另一种单质和另一种化合物的反应;
分解反应:指一种化合物分解成二种或二种以上较简单的单质或化合物的反应;
化合反应:指的是由两种或两种以上的物质生成一种新物质的反应;
复分解反应:是由两种化合物互相交换成分,生成另外两种化合物的反应;
(3)C2H5OH、CO2与强酸不反应;Fe2O3与盐酸反应生成氯化铁和水;FeCl3与强酸不反应;KOH与盐酸反应生成氯化钾和水;
(4)根据氢氧化铁胶体的制备方法和胶体的性质进行判断;
(5)依据铁离子遇到硫氰酸钾溶液会生成血红色溶液,已知甲能发生如下变化:甲
| Fe |
| 气体丙 |
| Fe |
| Cl2 |
①甲到乙是氯化铁和铁反应生成氯化亚铁;气体丙为氯气,乙到甲是氯气氧化亚铁离子生成铁离子;
②氯化铁溶液和铜反应生成氯化铜和氯化亚铁.
解答:
解:(1)CH3CH2OH不是氧化物;在水中和熔化状态下都不能导电,属于非电解质,
二氧化碳是氧化物;在水溶液中与水反应生成碳酸,二氧化碳自身不能电离,是非电解质,
Fe2O3是氧化物;在熔融状态下能够导电,属于电解质,
FeCl3不是氧化物;在水溶液中能够导电,属于电解质,
KOH不是氧化物;在水溶液中能够导电,属于电解质,
故相连的两种物质都是电解质的是CD;都是氧化物的是B;
故答案为:CD;B;
(2)C2H5OH与CO2不能反应;CO2与Fe2O3不能反应;Fe2O3与FeCl3不能反应;
FeCl3与KOH能够发生反应,生成氢氧化铁沉淀和氯化钾,属于复分解反应;
故答案为:D;复分解;
(3)C2H5OH、CO2与强酸不反应;Fe2O3与盐酸反应生成氯化铁和水;FeCl3与强酸不反应;KOH与盐酸反应生成氯化钾和水;
故符合条件的反应为Fe2O3与盐酸反应生成氯化铁和水,离子方程式为:Fe2O3+6H+=2Fe3++3H2O;
故答案为:Fe2O3+6H+=2Fe3++3H2O;
(4)用洁净的烧杯取25mL蒸馏水,加热至沸腾,向烧杯中逐滴加入氯化铁的饱和溶液,加热煮沸至液体呈红褐色,得到的分散系称为胶体,要证明胶体的实验的方法是丁达尔效应,
故答案为:胶体;丁达尔效应;
(5)依据铁离子遇到硫氰酸钾溶液会生成血红色溶液,已知甲能发生如下变化:甲
乙
甲,为FeCl3
FeCL2
FeCL3;
故答案为:FeCl3;
①甲到乙是氯化铁和铁反应生成氯化亚铁,化学方程式为:2FeCl3+Fe=3FeCl2;气体丙为氯气,乙到甲是氯气氧化亚铁离子生成铁离子,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-;
故答案为:2FeCl3+Fe=3FeCl2;Cl2;2Fe2++Cl2=2Fe3++2Cl-;
②氯化铁溶液和铜反应生成氯化铜和氯化亚铁,反应的离子方程式为:2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+.
二氧化碳是氧化物;在水溶液中与水反应生成碳酸,二氧化碳自身不能电离,是非电解质,
Fe2O3是氧化物;在熔融状态下能够导电,属于电解质,
FeCl3不是氧化物;在水溶液中能够导电,属于电解质,
KOH不是氧化物;在水溶液中能够导电,属于电解质,
故相连的两种物质都是电解质的是CD;都是氧化物的是B;
故答案为:CD;B;
(2)C2H5OH与CO2不能反应;CO2与Fe2O3不能反应;Fe2O3与FeCl3不能反应;
FeCl3与KOH能够发生反应,生成氢氧化铁沉淀和氯化钾,属于复分解反应;
故答案为:D;复分解;
(3)C2H5OH、CO2与强酸不反应;Fe2O3与盐酸反应生成氯化铁和水;FeCl3与强酸不反应;KOH与盐酸反应生成氯化钾和水;
故符合条件的反应为Fe2O3与盐酸反应生成氯化铁和水,离子方程式为:Fe2O3+6H+=2Fe3++3H2O;
故答案为:Fe2O3+6H+=2Fe3++3H2O;
(4)用洁净的烧杯取25mL蒸馏水,加热至沸腾,向烧杯中逐滴加入氯化铁的饱和溶液,加热煮沸至液体呈红褐色,得到的分散系称为胶体,要证明胶体的实验的方法是丁达尔效应,
故答案为:胶体;丁达尔效应;
(5)依据铁离子遇到硫氰酸钾溶液会生成血红色溶液,已知甲能发生如下变化:甲
| Fe |
| 气体丙 |
| Fe |
| Cl2 |
故答案为:FeCl3;
①甲到乙是氯化铁和铁反应生成氯化亚铁,化学方程式为:2FeCl3+Fe=3FeCl2;气体丙为氯气,乙到甲是氯气氧化亚铁离子生成铁离子,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-;
故答案为:2FeCl3+Fe=3FeCl2;Cl2;2Fe2++Cl2=2Fe3++2Cl-;
②氯化铁溶液和铜反应生成氯化铜和氯化亚铁,反应的离子方程式为:2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+.
点评:本题考查电解质和非电解质、氧化物概念的辨析、四种基本反应类型的判断、离子方程式的书写、胶体的制备及性质等知识,难度中等.要注意基础知识的积累.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
水热法制备直径为1~100nm的颗粒Y(化合物),反应原理为:3Fe2++2S2O32-+O2+aOH-=Y+S4O62-+2H2O,下列说法中不正确的是( )
| A、a=4 |
| B、Y是四氧化三铁,是氧化产物 |
| C、每有3mol Fe2+参加反应,反应中转移的电子总数为5mol |
| D、将Y均匀分散到水中形成的体系可以发生电泳现象 |
某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是( )
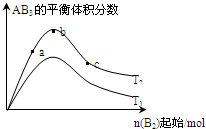

| A、反应速率a>b>c |
| B、若T2>T1,则正反应一定是吸热反应 |
| C、达到平衡时,AB3的物质的量大小为:b>c>a |
| D、达到平衡时A2的转化率大小为:b>a>c |
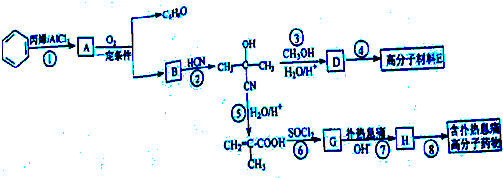
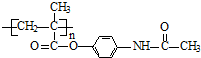
有机化合物A(C8H8O2)为一种无色液体.从A出发可发生如图的一系列反应.则下列说法正确的是( )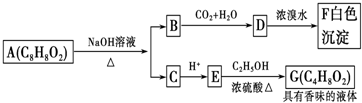

| A、根据图示可推知D为苯酚 |
| B、G的同分异构体中属于酯且能发生银镜反应的只有一种 |
| C、上述各物质中能发生水解反应的有A、B、D、G |
| D、A的结构中含有碳碳双键 |
 .
.