题目内容
3.下列对化学用语的理解正确的是( )| A. | 原子结构示意图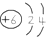 ,可以表示12C原子或13C原子 ,可以表示12C原子或13C原子 | |
| B. | 乙烯的结构简式:CH2CH2 | |
| C. | 电子式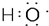 可以表示羟基或氢氧根离子 可以表示羟基或氢氧根离子 | |
| D. | CO2的比例模型: |
分析 A.C原子质子数等于核外电子数;
B.烯烃中含有碳碳双键,结构简式中碳碳双键不能省略;
C.氢氧根离子的电子式和羟基不同;
D.比例模型表示原子的相对大小及原子连接顺序、空间结构.
解答 解:A.C原子质子数等于核外电子数=6,故A正确;
B.乙烯的结构简式为:CH2=CH2,故B错误;
C.氢氧根离子的电子式和羟基不同,氢氧根离子中氧原子与氢原子之间形成1对共用电子对,带1个单位的负电荷,电子式为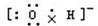 ,故C错误;
,故C错误;
D.二氧化碳的分子式为CO2,由模型可知小球为碳原子,2个大球为氧原子,氧原子半径大,实际碳原子半径大于氧原子半径,故D错误,
故选A.
点评 本题考查常用化学用语,难度不大,加强基础知识的掌握理解,注意D选项容易受分子式的书写影响.

练习册系列答案
相关题目
16.学习卤素后发现一种规律,某元素的单质或化合物通过缔合易溶于该元素的化合物中,如I2易溶于KI溶液中,HF易溶于NaF溶液中,属于上述情况的是( )
| A. | Br2易用于溴苯中 | B. | S易用于CS2中 | ||
| C. | S易溶于Na2S溶液中 | D. | AgF易溶于水中 |
17.摩尔质量最大的化合物是( )
| A. | CO2 | B. | O2 | C. | HCl | D. | Cl2 |
14.下列有关说法正确的是( )
| A. | 0.5molH2SO4与0.5molBa(OH)2完全反应所放出的热量,即为中和热 | |
| B. | 加入催化剂,活化分子的百分含量和数目都增大,从而反应速率增大 | |
| C. | NaCl溶液能导电,所以NaCl溶液是电解质 | |
| D. | 牺牲阳极的阴极保护法,是根据电解原理防护金属腐蚀 |
1.一定温度下,在固定体积的密闭容器中进行可逆反应:N2+3H2?2NH3.该反应达到平衡的标志是( )
| A. | 3v(H2)正=2v(NH3)逆 | B. | 容器内的总压强不再随时间而变化 | ||
| C. | N2、H2、NH3的分子数之比为1:3:2 | D. | 混合气体的密度不再随时间变化 |
8.等质量的下列烃完全燃烧时,消耗氧气最多的是( )
| A. | CH4 | B. | C2H4 | C. | C2H6 | D. | C6H8 |
15.1,2,3-三苯基环丙烷的三个苯基可以分布在环丙烷环平面的上下,因此有如下所示两个异构体.则有机物 的二氯代物有
的二氯代物有 (
( 是苯基,环用键线式表示,C、H原子都未画出)( )
是苯基,环用键线式表示,C、H原子都未画出)( )
 的二氯代物有
的二氯代物有 (
( 是苯基,环用键线式表示,C、H原子都未画出)( )
是苯基,环用键线式表示,C、H原子都未画出)( )| A. | 3种 | B. | 4种 | C. | 6种 | D. | 7种 |
12. 甲醇脱氢可制取甲醛:CH3OH(g)?HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如图所示(已知反应在1L的密闭容器中进行、甲醇的物质的量为1mol).下列有关说法中正确的是( )
甲醇脱氢可制取甲醛:CH3OH(g)?HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如图所示(已知反应在1L的密闭容器中进行、甲醇的物质的量为1mol).下列有关说法中正确的是( )
 甲醇脱氢可制取甲醛:CH3OH(g)?HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如图所示(已知反应在1L的密闭容器中进行、甲醇的物质的量为1mol).下列有关说法中正确的是( )
甲醇脱氢可制取甲醛:CH3OH(g)?HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如图所示(已知反应在1L的密闭容器中进行、甲醇的物质的量为1mol).下列有关说法中正确的是( )| A. | 脱氢反应的△H<0 | B. | 600 K时,Y点甲醇的v(逆)<v(正) | ||
| C. | 从Y点到Z点可通过增大压强 | D. | 在t1K时,该反应的平衡常数为8.1 |
13.在下列溶液中,各组离子一定能够大量共存的是( )
| A. | 25℃由水电离的c(H+)=10-12mol/L 的溶液:Fe3+ Cl- NO3- K+ | |
| B. | 使酚酞变红的溶液:Na+ Cl- SO42-AlO2- | |
| C. | 某无色溶液:HCO3- NO3- Al3+ Ba2+ | |
| D. | 25℃时,pH=1的溶液:Ba2+ NO3- K+ I- |