题目内容
13.在下列溶液中,各组离子一定能够大量共存的是( )| A. | 25℃由水电离的c(H+)=10-12mol/L 的溶液:Fe3+ Cl- NO3- K+ | |
| B. | 使酚酞变红的溶液:Na+ Cl- SO42-AlO2- | |
| C. | 某无色溶液:HCO3- NO3- Al3+ Ba2+ | |
| D. | 25℃时,pH=1的溶液:Ba2+ NO3- K+ I- |
分析 A.25℃由水电离的c(H+)=10-12mol/L 的溶液为酸或碱溶液,铁离子能够与氢氧根离子反应;
B.使酚酞变红的溶液中存在大量氢氧根离子,四种离子之间不反应,都不与氢氧根离子反应;
C.碳酸氢根离子与铝离子发生双水解反应;
D.pH=1的溶液为酸性溶液,硝酸根离子在酸性条件下能够氧化碘离子.
解答 解:A.25℃由水电离的c(H+)=10-12mol/L 的溶液中存在大量氢离子或氢氧根离子,Fe3+与氢氧根离子反应,在碱性溶液中不能大量共存,故A错误;
B.使酚酞变红的溶液为碱性溶液,溶液中存在大量氢氧根离子,Na+、Cl-、SO42-、AlO2-之间不反应,都不与氢氧根离子反应,在溶液中能够大量共存,故B正确;
C.HCO3-、Al3+之间发生双水解反应,在溶液中不能大量共存,故C错误;
D.pH=1的溶液为酸性溶液,NO3-、I-在酸性条件下发生氧化还原反应,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
相关题目
3.下列对化学用语的理解正确的是( )
| A. | 原子结构示意图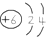 ,可以表示12C原子或13C原子 ,可以表示12C原子或13C原子 | |
| B. | 乙烯的结构简式:CH2CH2 | |
| C. | 电子式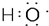 可以表示羟基或氢氧根离子 可以表示羟基或氢氧根离子 | |
| D. | CO2的比例模型: |
4.氯化铁是常见的水处理剂,工业上制备无水FeCl3的一种工艺如下:
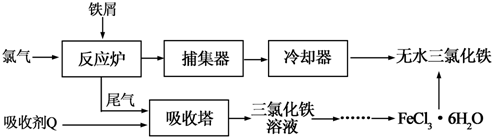
(1)试写出吸收塔中吸收剂Q反应的离子方程式:2Fe2++Cl2=2Fe3++2Cl-.
(2)六水合氯化铁在水中的溶解度如下:
从FeCl3溶液制得FeCl3•6H2O晶体的操作步骤是:加入少量盐酸、加热浓缩;、冷却结晶、过滤、洗涤、干燥.再由FeCl3•6H2O晶体得到无水FeCl3的操作是:在氯化氢气流中加热FeCl3•6H2O晶体,得到无水FeCl3.
(3)常温下,若溶液的pH控制不当会使Fe3+沉淀,pH=4时,溶液中c(Fe3+)=4×10-8mol•L-1.(常温下Ksp[Fe(OH)3]=4×10-38).
(4)氯化铁溶液称为化学试剂中的“多面手”,写出SO2通入氯化铁溶液中反应的离子方程式SO2+2H2O+2Fe3+=2Fe2++4H++SO42-.
(5)向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生新的沉淀,写出该沉淀的化学式Fe(OH)3.请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释Fe3+会水解产生较多的H+:Fe3++3H2O?Fe(OH)3+3H+,加入CuO与H+反应生成Cu2+和H2O,降低了H+浓度,使得水解平衡正向移动,生成Fe(OH)3沉淀.

(1)试写出吸收塔中吸收剂Q反应的离子方程式:2Fe2++Cl2=2Fe3++2Cl-.
(2)六水合氯化铁在水中的溶解度如下:
| 温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
| 溶解度(g/100gH2O) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
(3)常温下,若溶液的pH控制不当会使Fe3+沉淀,pH=4时,溶液中c(Fe3+)=4×10-8mol•L-1.(常温下Ksp[Fe(OH)3]=4×10-38).
(4)氯化铁溶液称为化学试剂中的“多面手”,写出SO2通入氯化铁溶液中反应的离子方程式SO2+2H2O+2Fe3+=2Fe2++4H++SO42-.
(5)向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生新的沉淀,写出该沉淀的化学式Fe(OH)3.请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释Fe3+会水解产生较多的H+:Fe3++3H2O?Fe(OH)3+3H+,加入CuO与H+反应生成Cu2+和H2O,降低了H+浓度,使得水解平衡正向移动,生成Fe(OH)3沉淀.
18.下列物品或设备:①工业制粗硅 ②门窗玻璃 ③水晶项链 ④石英钟表 ⑤玛瑙手镯 ⑥硅太阳能电池 ⑦光导纤维 ⑧计算机芯片.所用材料为SiO2或要用到SiO2的是( )
| A. | ①②③④⑤⑦ | B. | 全部 | C. | ③④⑤⑦⑧ | D. | ①②⑦⑧ |
 .
.
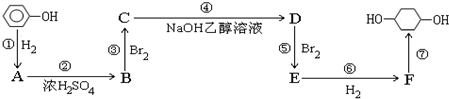
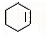 ; F
; F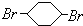 ;
;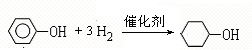 ;
;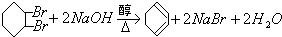 .
.