题目内容
16.学习卤素后发现一种规律,某元素的单质或化合物通过缔合易溶于该元素的化合物中,如I2易溶于KI溶液中,HF易溶于NaF溶液中,属于上述情况的是( )| A. | Br2易用于溴苯中 | B. | S易用于CS2中 | ||
| C. | S易溶于Na2S溶液中 | D. | AgF易溶于水中 |
分析 I2易溶于KI溶液中,发生I2(aq)+I-(aq)=I3-,则卤素单质与离子结合生成离子的符合,以此来解答.
解答 解:A.溴苯不能电离出溴离子,不符合,故A不选;
B.S易用于CS2中,为相似相容,不发生单质与离子的反应,故B不选;
C.发生S单质与硫离子的反应,符合上述规律,故C选;
D.不存在HF,不能发生上述规律的反应,故D不选;
故选C.
点评 本题考查卤素单质的性质及规律性知识,为高频考点,把握习题中的信息、发生的反应为解答的关键,侧重分析与迁移应用能力的考查,题目难度不大.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
11.前四周期元素A、B、C、D、E、F原子序数依次增大,其相关性质如下表所示:
(1)E元素基态原子核外有24种空间运动状态不同的电子,电子排布式为1s22s22p63s23p63d54s1,
F元素在元素周期表中的位置为第四周期ⅠB族,F元素基态原子的外围电子排布图是 .
.
(2)B和C可形成一种同时含有共价键和离子键的化合物,其电子式为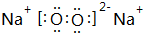 .
.
(3)A、B、C、D四种元素第一电离能由大到小的顺序为(用元素符号表示)N>O>S>NaB、C、D三种元素的简单离子的半径由大到小的顺序(用离子符号表示)为S2->O2->Na+.
(4)许多金属盐都可以发生焰色反应(如元素C),其原因是激发态的电子从能量较高的轨道跃迁到能量较低的轨道时,以一定波长(可见光区域)光的形式释放能量.
| A | 2p能级电子半充满 |
| B | 与A同周期,且原子核外有2个未成对电子 |
| C | 基态原子核外有6个原子轨道排有电子,且只有1个未成对电子 |
| D | 其基态原子外围电子排布为msnmpn+2 |
| E | 前四周期元素中,E元素基态原子未成对电子数最多 |
| F | 基态F+各能级电子全充满 |
F元素在元素周期表中的位置为第四周期ⅠB族,F元素基态原子的外围电子排布图是
 .
.(2)B和C可形成一种同时含有共价键和离子键的化合物,其电子式为
 .
.(3)A、B、C、D四种元素第一电离能由大到小的顺序为(用元素符号表示)N>O>S>NaB、C、D三种元素的简单离子的半径由大到小的顺序(用离子符号表示)为S2->O2->Na+.
(4)许多金属盐都可以发生焰色反应(如元素C),其原因是激发态的电子从能量较高的轨道跃迁到能量较低的轨道时,以一定波长(可见光区域)光的形式释放能量.
1.在含有0.078molFeCl2溶液中通入0.009molCl2,再加入含有0.01molX2O72-的酸性溶液,使溶液中的Fe2+恰好全部氧化,并使X2O72-还原成xn+离子,n值为( )
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
8.有关盐类水解应用的叙述不正确的是( )
| A. | 热的纯碱溶液去污能力增强 | |
| B. | 配制FeCl3溶液,可加入少量的稀硫酸,以防止溶液浑浊 | |
| C. | 加热蒸干Al2(SO4)3溶液,最终能得到Al2(SO4)3晶体 | |
| D. | 利用明矾净水 |
5.下列有关铁及其化合物的说法中正确的是( )
| A. | 赤铁矿的主要成分是Fe3O4 | |
| B. | 铁与水蒸气在高温下的反应产物为Fe2O3和H2 | |
| C. | 除去FeCl2溶液中的FeCl3杂质可以向溶液中加入铁粉,然后过滤 | |
| D. | Fe3+与KSCN产生红色沉淀,铁与水蒸气在高温下的反应产物为Fe3O4和H2 |
3.下列对化学用语的理解正确的是( )
| A. | 原子结构示意图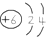 ,可以表示12C原子或13C原子 ,可以表示12C原子或13C原子 | |
| B. | 乙烯的结构简式:CH2CH2 | |
| C. | 电子式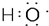 可以表示羟基或氢氧根离子 可以表示羟基或氢氧根离子 | |
| D. | CO2的比例模型: |
