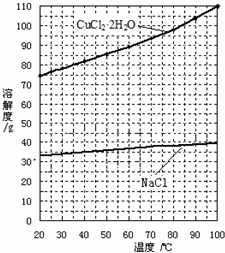
题目内容
某小组同学用如图装置进行实验研究(a、b、c表示止水夹).请评价或完善其方案:
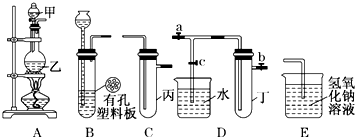
(1)将装置A、C、E相连接,用MnO2和浓盐酸制取氯气,请回答:
①氯元素在周期表中的位置为 .
②A中反应的离子方程式: .
③E中氢氧化钠溶液的作用 .
在C中加入适量的水可制得氯水.将所得氯水分成两份进行实验,其操作、现象和结论为:
④实验Ⅰ推出的相应结论是否合理? ,若不合理,请说明理由(若合理,无需填写) .
⑤实验Ⅱ推出相应的结论是否合理? ,若不合理,请说明理由(若合理,无需填写) .
(2)为比较Cl2和I2的氧化性强弱,将A、C、E相连,C中盛的试剂可以为 .
(3)将B、D、E相连,在B中装浓硝酸和铜片,可制得NO2并进行有关实验.
①B中反应的化学方程式 .
②先若关闭c,当丁中充满红棕色的NO2时,再关闭止水夹a、b,微热试管丁,丁中可观察到的实验现象 .

(1)将装置A、C、E相连接,用MnO2和浓盐酸制取氯气,请回答:
①氯元素在周期表中的位置为
②A中反应的离子方程式:
③E中氢氧化钠溶液的作用
在C中加入适量的水可制得氯水.将所得氯水分成两份进行实验,其操作、现象和结论为:
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 品红溶液褪色 | 氯气有漂白性 |
| Ⅱ | 氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯气与水反应的产物具有酸性 |
⑤实验Ⅱ推出相应的结论是否合理?
(2)为比较Cl2和I2的氧化性强弱,将A、C、E相连,C中盛的试剂可以为
(3)将B、D、E相连,在B中装浓硝酸和铜片,可制得NO2并进行有关实验.
①B中反应的化学方程式
②先若关闭c,当丁中充满红棕色的NO2时,再关闭止水夹a、b,微热试管丁,丁中可观察到的实验现象
考点:实验装置综合,氯气的实验室制法
专题:实验题
分析:(1)①氯为17号元素,在第三周期第ⅦA族;
②A中二氧化锰和浓盐酸反应制取氯气,据此写出反应的离子方程式;
③根据氯气有毒,氯气能够与氢氧化钠溶液反应分析;
④验证氯气与水反应的产物具有漂白性应首先排除干燥氯气的影响,需要进行对比实验;
⑤制取的氯气中含有HCl气体,HCl溶于水后能与碳酸氢钠粉末反应产生气泡;
(2)氯气的氧化性强于溴,氯气可以将溴从其盐溶液中置换出来;
(3)①浓硝酸具有强氧化性,与铜反应生成二氧化氮气体;
②NO2中存在2NO2?N2O4(g)(正反应是放热反应),加热平衡逆移.
②A中二氧化锰和浓盐酸反应制取氯气,据此写出反应的离子方程式;
③根据氯气有毒,氯气能够与氢氧化钠溶液反应分析;
④验证氯气与水反应的产物具有漂白性应首先排除干燥氯气的影响,需要进行对比实验;
⑤制取的氯气中含有HCl气体,HCl溶于水后能与碳酸氢钠粉末反应产生气泡;
(2)氯气的氧化性强于溴,氯气可以将溴从其盐溶液中置换出来;
(3)①浓硝酸具有强氧化性,与铜反应生成二氧化氮气体;
②NO2中存在2NO2?N2O4(g)(正反应是放热反应),加热平衡逆移.
解答:
解:(1)①氯为17号元素,在周期表中的位置为第三周期第ⅦA族,故答案为:第三周期第ⅦA族;
②A中二氧化锰与浓盐酸反应生成氯气、氯化锰和水,反应的离子方程式为:MnO2+4H++2Cl-
Mn2++2H2O+Cl2↑,
故答案为:MnO2+4H++2Cl-
Mn2++2H2O+Cl2↑;
③氯气有毒,能污染空气,而且氯气能与氢氧化钠溶液反应,所以多余的氯气应该用氢氧化钠溶液吸收,故答案为:吸收多余的Cl2;
④没有事先证明干燥的氯气无漂白性,则不能证明氯气与水反应的产物是否具有漂白性,
故答案为:不合理;没有事先证明干燥的氯气无漂白性;
⑤浓盐酸易挥发,制取的氯气中含HCl能与NaHCO3反应产生气体,如要证明氯气与水反应的产物具有酸性,必须先除去HCl,可通入饱和食盐水除杂,
故答案为:不合理;制取的氯气中含有HCl气体,HCl溶于水后能与碳酸氢钠粉末反应产生气泡;
(2)A、C、E相连即为二氧化锰和浓盐酸反应制取氯气,氯气的氧化性强于溴,氯气可以将溴从其盐溶液中置换出来,所以C中的试剂可用KBr或NaBr,
故答案为:KBr或NaBr;
(3)①B中铜与浓硝酸反应生成硝酸铜、二氧化氮和水,发生反应的离子方程式为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,
故答案为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;
②NO2中存在2NO2?N2O4(g)(正反应是放热反应),加热平衡逆移,NO2的物质的量增大,丁中气体的颜色变深;
故答案为:丁中气体的红棕色变深.
②A中二氧化锰与浓盐酸反应生成氯气、氯化锰和水,反应的离子方程式为:MnO2+4H++2Cl-
| ||
故答案为:MnO2+4H++2Cl-
| ||
③氯气有毒,能污染空气,而且氯气能与氢氧化钠溶液反应,所以多余的氯气应该用氢氧化钠溶液吸收,故答案为:吸收多余的Cl2;
④没有事先证明干燥的氯气无漂白性,则不能证明氯气与水反应的产物是否具有漂白性,
故答案为:不合理;没有事先证明干燥的氯气无漂白性;
⑤浓盐酸易挥发,制取的氯气中含HCl能与NaHCO3反应产生气体,如要证明氯气与水反应的产物具有酸性,必须先除去HCl,可通入饱和食盐水除杂,
故答案为:不合理;制取的氯气中含有HCl气体,HCl溶于水后能与碳酸氢钠粉末反应产生气泡;
(2)A、C、E相连即为二氧化锰和浓盐酸反应制取氯气,氯气的氧化性强于溴,氯气可以将溴从其盐溶液中置换出来,所以C中的试剂可用KBr或NaBr,
故答案为:KBr或NaBr;
(3)①B中铜与浓硝酸反应生成硝酸铜、二氧化氮和水,发生反应的离子方程式为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,
故答案为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;
②NO2中存在2NO2?N2O4(g)(正反应是放热反应),加热平衡逆移,NO2的物质的量增大,丁中气体的颜色变深;
故答案为:丁中气体的红棕色变深.
点评:本题考查了氯气的实验室制法、氯气的化学性质、二氧化氮的制取及二氧化氮的性质,题目难度中等,注意掌握实验室制取氯气的反应原理及氯气的化学性质,试题侧重对学生能力的培养和训练,有利于培养学生规范严谨的实验设计、操作能力.

练习册系列答案
相关题目
下列有关化学用语表示正确的是( )
| A、质量数均为14的碳原子和氮原子表示为:614C 714N |
B、甲烷的球棍模型: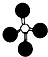 |
C、甲基的结构式: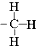 |
D、甲基负离子的电子式: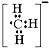 |
如图是产生和收集气体的实验装置,该装置适合于( )
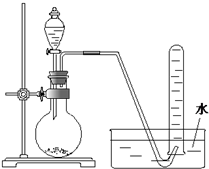

| A、用H2O2溶液和MnO2反应制取O2 |
| B、用浓盐酸和MnO2反应制取Cl2 |
| C、用稀硫酸与石灰石反应制取CO2 |
| D、用NH4Cl和Ca(OH)2反应制取NH3 |
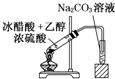
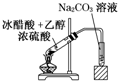

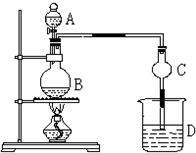 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸,D中放有饱和碳酸钠溶液.(已知:无水氯化钙可与乙醇形成难溶于水的CaCl2?6C2H5OH)请回答下列问题:
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸,D中放有饱和碳酸钠溶液.(已知:无水氯化钙可与乙醇形成难溶于水的CaCl2?6C2H5OH)请回答下列问题:
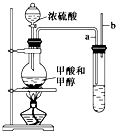 已知甲酸(HCOOH)是羧酸中组成最简单的酸,它具有羧酸的性质,在实验室里常用甲酸在浓硫酸的作用下制取少量一氧化碳,现用甲酸与甲醇反应制取甲酸甲酯来验证甲酸具有能发生酯化反应的性质,装置如图所示
已知甲酸(HCOOH)是羧酸中组成最简单的酸,它具有羧酸的性质,在实验室里常用甲酸在浓硫酸的作用下制取少量一氧化碳,现用甲酸与甲醇反应制取甲酸甲酯来验证甲酸具有能发生酯化反应的性质,装置如图所示