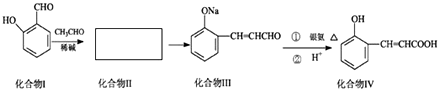
��Ŀ����
�״���һ�ֿ�������Դ�����п�����Ӧ�õĹ���ǰ������ҵ��һ����CO��H2Ϊԭ�Ϻϳɼ״����÷�Ӧ���Ȼ�ѧ����ʽΪ��CO��g��+2H2��g��?CH3OH��g����H1=-116kJ?mol-1
��1�������й�������Ӧ��˵����ȷ���� ��
a�����¡����������£������ڵ�ѹǿ�������仯����淴Ӧ�ﵽƽ��
b��һ�������£�H2������������CO���������ʵ�2��ʱ���淴Ӧ�ﵽƽ��
c����������������䣬�����¶ȿ����CO��ת����
d��ʹ�ú��ʵĴ��������̴ﵽƽ���ʱ�䲢���CH3OH�IJ���
��2�����ݻ�Ϊ1L�ĺ��������У��ֱ��о���230�桢250�桢270�������¶��ºϳɼ״��Ĺ��ɣ�ͼ1�����������¶��²�ͬ��H2��CO����ʼ��ɱȣ���ʼʱCO�����ʵ�����Ϊ1mol����COƽ��ת���ʵĹ�ϵ��
�������������¶��У�����Z��Ӧ���¶��� ��
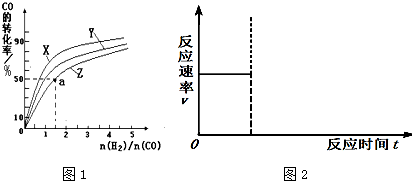
������ͼ1��a���Ӧ�����ݣ�����÷�Ӧ�ڶ�Ӧ�¶��µ�ƽ�ⳣ��K ��д��������̣���
���ڴ����Ӧλ���ϻ�����������Ӧ�ﵽƽ���С��ϵѹǿ���ﵽ�µ�ƽ������У����淴Ӧ������ʱ��ı仯��ϵͼ2����ע��
��3����֪��CO��g��+
O2��g��=CO2��g����H2=-283kJ?mol-1H2��g��+
O2��g��=H2O��g����H3=-242kJ?mol-1���ʾ1mol��̬�״���ȫȼ������CO2��ˮ����ʱ���Ȼ�ѧ����ʽΪ ��
��1�������й�������Ӧ��˵����ȷ����
a�����¡����������£������ڵ�ѹǿ�������仯����淴Ӧ�ﵽƽ��
b��һ�������£�H2������������CO���������ʵ�2��ʱ���淴Ӧ�ﵽƽ��
c����������������䣬�����¶ȿ����CO��ת����
d��ʹ�ú��ʵĴ��������̴ﵽƽ���ʱ�䲢���CH3OH�IJ���
��2�����ݻ�Ϊ1L�ĺ��������У��ֱ��о���230�桢250�桢270�������¶��ºϳɼ״��Ĺ��ɣ�ͼ1�����������¶��²�ͬ��H2��CO����ʼ��ɱȣ���ʼʱCO�����ʵ�����Ϊ1mol����COƽ��ת���ʵĹ�ϵ��
�������������¶��У�����Z��Ӧ���¶���

������ͼ1��a���Ӧ�����ݣ�����÷�Ӧ�ڶ�Ӧ�¶��µ�ƽ�ⳣ��K ��д��������̣���
���ڴ����Ӧλ���ϻ�����������Ӧ�ﵽƽ���С��ϵѹǿ���ﵽ�µ�ƽ������У����淴Ӧ������ʱ��ı仯��ϵͼ2����ע��
��3����֪��CO��g��+
| 1 |
| 2 |
| 1 |
| 2 |
���㣺��ѧƽ���Ӱ������,�Ȼ�ѧ����ʽ,ת�������¶ȡ�ѹǿ�ı仯����
ר�⣺��ѧƽ��ר��
��������1�����ݷ�Ӧ����ʽ����������ƽ���ƶ������֪ʶ���������
��2���ٺϳɼ״��ķ�Ӧ�Ƿ��ȷ�Ӧ���¶����ߣ�ת���ʽ��ͣ�
�ڸ���ƽ�ⳣ�������������⣻
��������Ӧ�ﵽƽ���С��ϵѹǿ���ﵽ�µ�ƽ������У����淴Ӧ���ʶ���С����ƽ������Ӧ���ʼ�С�ķ��ȴ��淴Ӧ���ʼ�С�ķ���С��ƽ�������ƶ���
��3�����ݸ�˹���ɺ������Ȼ�ѧ����ʽд���״���ȫȼ�����ɶ�����̼���Ȼ�ѧ����ʽ��
��2���ٺϳɼ״��ķ�Ӧ�Ƿ��ȷ�Ӧ���¶����ߣ�ת���ʽ��ͣ�
�ڸ���ƽ�ⳣ�������������⣻
��������Ӧ�ﵽƽ���С��ϵѹǿ���ﵽ�µ�ƽ������У����淴Ӧ���ʶ���С����ƽ������Ӧ���ʼ�С�ķ��ȴ��淴Ӧ���ʼ�С�ķ���С��ƽ�������ƶ���
��3�����ݸ�˹���ɺ������Ȼ�ѧ����ʽд���״���ȫȼ�����ɶ�����̼���Ȼ�ѧ����ʽ��
���
�⣺��1��a�����¡����������£������ڵ�ѹǿ�������仯��˵������������ʵ������䣬����淴Ӧ�ﵽƽ�⣬��a��ȷ��
b��һ�������£�H2������������CO���������ʵ�2��������ӳ�����������Բ�һ���ﵽƽ�⣬��b����
c����������������䣬�����¶ȣ�ƽ�������ƶ���CO��ת���ʽ��ͣ���c����
d��ʹ�ú��ʵĴ��������̴ﵽƽ���ʱ�䣬ƽ�ⲻ�ƶ������Բ��ı�CH3OH�IJ�������d����ѡ��a��
��2���ٸ��ݷ�ӦCO��g��+2H2��g��?CH3OH��g����H1=-116kJ?mol-1���Ƿ��ȷ�Ӧ���¶�Խ�ߣ�ת����Խ�ͣ���������Z��Ӧ���¶���270�棬
�ʴ��ǣ�270�棻
�ڸ���ͼ���֪CO��ת����Ϊ50%��H2�����ʵ���Ϊ1.5 mol
CO��g��+2H2��g��?CH3OH��g��
��ʼ���ʵ���Ũ�ȣ�mol/L�� 1 1.5 0
ת�����ʵ���Ũ�ȣ�mol/L�� 0.5 1 0.5
ƽ�����ʵ���Ũ�ȣ�mol/L�� 0.5 0.5 0.5
K=
=
=4L2?mol-2
�ʴ�Ϊ��4L2?mol-2��
��������Ӧ�ﵽƽ���С��ϵѹǿ���ﵽ�µ�ƽ������У����淴Ӧ���ʶ���С����ƽ������Ӧ���ʼ�С�ķ��ȴ��淴Ӧ���ʼ�С�ķ���С��ƽ�������ƶ�
������ͼ��Ϊ��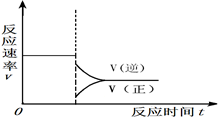 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��3����CO��g��+2H2��g��?CH3OH��g����H1=-116kJ?mol-1
��CO��g��+
O2��g��=CO2��g����H2=-283kJ?mol-1
��H2��g��+
O2��g��=H2O��g����H3=-242kJ?mol-1 ���ݸ�˹���ɣ�-��+��+�ۡ�2�ã�
CH3OH��g��+
O2��g��=CO2��g��+2H2O��g����H=-651kJ?mol-1��
�ʴ��ǣ�CH3OH��g��+
O2��g��=CO2��g��+2H2O��g����H=-651kJ?mol-1��
b��һ�������£�H2������������CO���������ʵ�2��������ӳ�����������Բ�һ���ﵽƽ�⣬��b����
c����������������䣬�����¶ȣ�ƽ�������ƶ���CO��ת���ʽ��ͣ���c����
d��ʹ�ú��ʵĴ��������̴ﵽƽ���ʱ�䣬ƽ�ⲻ�ƶ������Բ��ı�CH3OH�IJ�������d����ѡ��a��
��2���ٸ��ݷ�ӦCO��g��+2H2��g��?CH3OH��g����H1=-116kJ?mol-1���Ƿ��ȷ�Ӧ���¶�Խ�ߣ�ת����Խ�ͣ���������Z��Ӧ���¶���270�棬
�ʴ��ǣ�270�棻
�ڸ���ͼ���֪CO��ת����Ϊ50%��H2�����ʵ���Ϊ1.5 mol
CO��g��+2H2��g��?CH3OH��g��
��ʼ���ʵ���Ũ�ȣ�mol/L�� 1 1.5 0
ת�����ʵ���Ũ�ȣ�mol/L�� 0.5 1 0.5
ƽ�����ʵ���Ũ�ȣ�mol/L�� 0.5 0.5 0.5
K=
| c(CH3OH) |
| c2(H2)?c(CO) |
| 0.5mol/L |
| (0.5mol/L)2��0.5mol/L |
�ʴ�Ϊ��4L2?mol-2��
��������Ӧ�ﵽƽ���С��ϵѹǿ���ﵽ�µ�ƽ������У����淴Ӧ���ʶ���С����ƽ������Ӧ���ʼ�С�ķ��ȴ��淴Ӧ���ʼ�С�ķ���С��ƽ�������ƶ�
������ͼ��Ϊ��
 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
����3����CO��g��+2H2��g��?CH3OH��g����H1=-116kJ?mol-1
��CO��g��+
| 1 |
| 2 |
��H2��g��+
| 1 |
| 2 |
CH3OH��g��+
| 3 |
| 2 |
�ʴ��ǣ�CH3OH��g��+
| 3 |
| 2 |
���������⿼����Ӱ�췴Ӧ���ʵ����ؼ���Ӧƽ�ⳣ���ļ��㡢�Ȼ�ѧ����ʽ����д��֪ʶ��ע���˹���ɵ�Ӧ�ã������Ѷ��е�

��ϰ��ϵ�д�
�����Ŀ
�������ӷ���ʽ��д��ȷ���ǣ�������
| A�������е���̼������Һ��CO32-+2H+=H2O+CO2�� |
| B��������ϡ���ᷴӦ��2Fe+6H+=2Fe3++3H2�� |
| C�������е�������������Һ��HCl+OH-=H2O+Cl- |
| D��ϡ�������ʯ��ʯ�ϣ�CO32-+2H+=H2O+CO2�� |
һ�������£���ij�ܱ������м���һ������N2��H2�������淴ӦN2��g��+3H2��g��?2NH3��g����H=-92.2kJ?mol-1�����0��10���ڣ�c��H2����С��0.75mol?L-1������˵����ȷ���ǣ�������
| A��10��15����c��NH3�� ����������0.25mol?L-1 |
| B��10���ڰ�����ƽ����Ӧ����Ϊ0.025mol?L-1?s-1 |
| C����ƽ����������NH3��v������ |
| D���÷�Ӧ���淴Ӧ�Ļ�ܲ�С��92.2kJ?mol-1 |
�ڹ�����ϡ������Һ�м���5.6g Fe�ۣ�����Ӧ��ȫ���ټ���50mL0.5mol?L-1KNO3��Һ��ǡ�÷�Ӧ��ȫ���÷�Ӧ�ķ���ʽΪ���� FeSO4+ KNO3+ H2SO4= K2SO4+ Fe2��SO4��3+ NxOy+ H2O������Ը÷�Ӧ������˵����ȷ���ǣ�������
| A����Ӧ�л�ԭ������NO |
| B����������ͻ�ԭ��������ʵ���֮��Ϊ1��8 |
| C����Ӧ������ת�Ƶĵ�����Ϊ4e- |
| D����ѧ����ʽ�а�����˳��ļ������ǣ�8��2��5��1��4��1��5 |