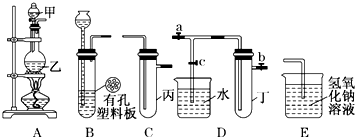
题目内容
制取乙酸乙酯的装置正确的是(其中B和D的玻璃导管插入到小试管内液面以下)( )
A、 |
B、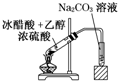 |
C、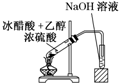 |
D、 |
考点:乙酸乙酯的制取
专题:实验题
分析:B和D中的玻璃管插到试管b内液面以下,会引起倒吸,B、D错;C、D项试管b中的试剂NaOH溶液会与生成的乙酸乙酯反应.
解答:
解:A.乙醇与乙酸都易挥发,制备的乙酸乙酯含有乙醇与乙酸,通常用饱和碳酸钠溶液吸收乙酸乙酯,中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸乙酯的香味,溶解挥发出来的乙醇,降低乙酸乙酯在水中的溶解度,便于分层得到酯,故A正确;
B.B中的玻璃管插到试饱和碳酸钠液面以下,会引起倒吸,故B错误;
C.C项试管中的试剂NaOH溶液会与生成的乙酸乙酯反应,故C错误;
D.D项试管中的试剂NaOH溶液会与生成的乙酸乙酯反应且玻璃管插入液面下,故D错误;
故选A.
B.B中的玻璃管插到试饱和碳酸钠液面以下,会引起倒吸,故B错误;
C.C项试管中的试剂NaOH溶液会与生成的乙酸乙酯反应,故C错误;
D.D项试管中的试剂NaOH溶液会与生成的乙酸乙酯反应且玻璃管插入液面下,故D错误;
故选A.
点评:本题考查了乙酸乙酯的制备,选择仪器时注意防倒吸、饱和碳酸钠溶液的作用,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列有关电化学原理的说法正确的是( )
| A、电解法冶炼铝时,阳极反应为:2O2--4e-=O2↑ |
| B、用电解法精练铜,阳极反应为:Cu2++2e-=Cu |
| C、钢铁在中性条件下被腐蚀,正极反应为:2H2O+2e-=H2↑+2OH- |
| D、铝-空气燃料电池以KOH为电解液时,负极反应为:Al-3e-=Al3+ |
下列离子方程式书写正确的是( )
| A、盐酸中滴入碳酸钠溶液:CO32-+2H+=H2O+CO2↑ |
| B、铁粉与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
| C、盐酸中滴入氢氧化钠溶液:HCl+OH-=H2O+Cl- |
| D、稀硝酸滴在石灰石上:CO32-+2H+=H2O+CO2↑ |
下列离子方程式正确的是( )
| A、Cu与浓硝酸反应:Cu+4HNO3(浓)=Cu2++2NO3-+2NO2↑+2H2O |
| B、食醋溶解水垢中的碳酸钙:2CH3COOH+CaCO3=Ca2++2CH3COO-+H2O+CO2↑ |
| C、氯化铝溶液中加入过量的氨水:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| D、向KAl(SO4)2 溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ |
下列叙述正确的是( )
A、
| ||||
B、
| ||||
| C、Na和K属于ⅠA族元素,Na的金属性比K强 | ||||
| D、Cl和Br属于VⅡA族元素,两原子核外电子数之差为8 |
在过量的稀硫酸溶液中加入5.6g Fe粉,待反应完全后,再加入50mL0.5mol?L-1KNO3溶液,恰好反应完全.该反应的方程式为:“ FeSO4+ KNO3+ H2SO4= K2SO4+ Fe2(SO4)3+ NxOy+ H2O”,则对该反应的下列说法正确的是( )
| A、反应中还原产物是NO |
| B、氧化产物和还原产物的物质的量之比为1:8 |
| C、反应过程中转移的电子数为4e- |
| D、化学方程式中按物质顺序的计量数是:8、2、5、1、4、1、5 |
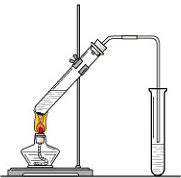 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题: