题目内容
3.配置0.1000mol/L CuSO4(aq) 100mL基本过程:①计算;②称量;③溶解;④转移,洗涤并转移;⑤定容;⑥摇匀.回答下列问题:(1)如用CuSO4配制,需CuSO4质量为1.6g;如用CuSO4•5H2O配制,称量中若物品和砝码的位置放反,实际称量得到的CuSO4•5H2O质量为1.5g(1g以下用游码);所配制溶液浓度偏小(填”偏大或偏小或无影响”).
(2)转移操作中必需的玻璃仪器除烧杯、玻璃棒外,还必需100mL容量瓶;其中玻璃棒的作用是引流;
(3)定容必需的仪器为胶头滴管.
分析 (1)依据m=CVM计算需要硫酸铜、CuSO4•5H2O的质量;托盘天平称量原理:左盘的质量=右盘质量+游码质量,据此判断称量中若物品和砝码的位置放反对溶质物质的量的影响,依据C=$\frac{n}{V}$进行误差分析;
(2)依据移液的正确操作步骤选择需要的仪器,判断玻璃棒作用;
(3)定容的正确操作为:继续向容量瓶中加入蒸馏水到液面距离刻度线1-2cm时改用胶头滴管逐滴滴加到凹液面最低处与刻度线相切,据此判断需要仪器;
解答 解:(1)配置0.1000mol/L CuSO4(aq) 100mL,需要硫酸铜的质量:0.1000mol/L×0.1L×160g/mol=1.6g;
若用CuSO4•5H2O配制,需要CuSO4•5H2O质量:0.1000mol/L×0.1L×250g/mol=2.5g,称量中若物品和砝码的位置放反则右盘的质量=左盘的质量-游码的质量=2g-0.5g=1.5g,所以实际秤取质量为1.5g,溶质的质量偏小,溶质的物质的量偏小,依据C=$\frac{n}{V}$可知溶液浓度偏低;
故答案为:1.6g 1.5g 偏小;
(2)移液时应将烧杯中溶液全部转移到100mL容量瓶中,因为容量瓶瓶颈较细,为防止液体撒在容量瓶外面,需要用玻璃棒引流;
故答案为:100mL容量瓶 引流;
(3)定容的正确操作为:继续向容量瓶中加入蒸馏水到液面距离刻度线1-2cm时改用胶头滴管逐滴滴加到凹液面最低处与刻度线相切,所以定容时需要用到仪器为胶头滴管;
故答案为:胶头滴管;
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理和过程是解题关键,注意托盘天平的使用方法和注意问题,题目难度不大.

练习册系列答案
相关题目
12.核反应不仅能发电也能制造元素.2016 年初国际上确认,利用原子核间的撞击已制造出原子序数分别为113、115、117 和118 四种新元素,填补了目前元素周期表的空白,其中113 号元素与Al 元素处于同一主族.下列说法正确的是( )
| A. | 核反应发电实现了化学能到电能的转化 | |
| B. | 115 号元素一定是处于VA 族的非金属元素 | |
| C. | 117 号元素与F、Cl、Br、I 均处于VIIA 族 | |
| D. | 四种新元素位于元素周期表中的不同周期 |
13.已知R2+核外有a个电子,b个中子,表示R原子符号正确的是( )
| A. | ${\;}_{a}^{b}$R | B. | ${\;}_{a-2}^{a+b-2}$R | C. | ${\;}_{a+2}^{a+b+2}$R | D. | ${\;}_{a-2}^{a+b+2}$R |
15.下列物质的性质比较,正确的是( )
| A. | 非金属性:P>S>Cl | B. | 碱性:NaOH>KOH>RbOH | ||
| C. | 气态氢化物稳定性:HF>HCl>HBr | D. | 酸性:H2SO4>HClO4>HBrO4 |
13.下列表示方法正确的是( )
| A. | HCl的电子式为 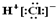 | B. | N2的结构式 N≡N | ||
| C. | O原子处于基态的轨道表示式: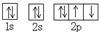 | D. | 用电子式表示MgCl2的形成: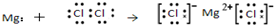 |
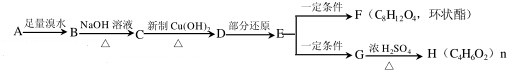
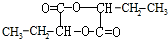 ,H
,H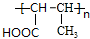 .
.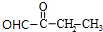 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$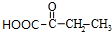 +Cu2O+2H2O,E→F2
+Cu2O+2H2O,E→F2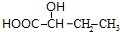 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$
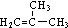 ,D分子中最多有8个原子共平面.
,D分子中最多有8个原子共平面.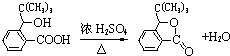 (写明反应条件).
(写明反应条件).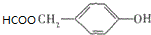 .
.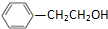 )
)