题目内容
15.下列物质的性质比较,正确的是( )| A. | 非金属性:P>S>Cl | B. | 碱性:NaOH>KOH>RbOH | ||
| C. | 气态氢化物稳定性:HF>HCl>HBr | D. | 酸性:H2SO4>HClO4>HBrO4 |
分析 A.同周期从左向右非金属性增强;
B.金属性越强,最高价氧化物水化物的碱性越强;
C.非金属性越强,对应氢化物越稳定;
D.非金属性越强,最高价氧化物水化物的酸性越强.
解答 解:A.同周期从左向右非金属性增强,则非金属性为P<S<Cl,故A错误;
B.碱性应该对应最高价氧化物对应水化物的碱性,对应的金属元素金属性越强,则碱性越强.正确顺序为NaOH<KOH<RbOH,故B错误;
C.非金属性F>Cl>Br,气态氢化物稳定性:HF>HCl>HBr,故C正确;
D.最高价氧化物对应水化物的酸性;非金属性越强,则酸性越强,则酸性为HClO4>H2SO4>HBrO4,故D错误;
故选C.
点评 本题考查元素周期表和周期表的综合应用,为高频考点,把握元素的位置、元素的性质、元素周期律等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
4.下列对分子及其性质的解释中,不正确的是( )
| A. | 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 | |
| B. | 乳酸[CH3CH(OH)COOH]中存在一个手性碳原子 | |
| C. | 许多过渡金属离子对多种配体具有很强的结合力,因而,只有过渡金属才能形成配合物 | |
| D. | 已知酸性:H3PO4>HClO,是因为H3PO4分子中有1个非羟基氧原子而HClO为0 |
5.一定温度下,向某密闭容器中以物质的量1:1充入适量X(g)和Y,发生可逆反应X(g)+Y?2Z,达到平衡时,X的浓度为0.06mol/L,保持温度不变,将容器体积扩大一倍,平衡时X的浓度仍为0.06mol/L,下列分析正确的是( )
| A. | Y可能为气态 | B. | Y一定为固态或液态 | ||
| C. | Z可能为气态 | D. | Z一定为固态或液态 |
10.下列各溶液与强酸溶液反应,不能用离子方程式HCO3-+H+=CO2↑+H2O 表示的是( )
| A. | 碳酸氢钾溶液 | B. | 纯碱溶液 | C. | 碳酸氢钙溶液 | D. | 小苏打溶液 |
7.乙炔分子CH≡CH加成可以得到CH2═CH-C≡CH(乙烯基乙炔),该物质是合成橡胶的重要原料.下列对该物质的判断中错误的是( )
| A. | 该物质与足量的H2加成后,只能生成一种物质 | |
| B. | 该物质既是CH2═CH2的同系物,又是CH≡CH的同系物 | |
| C. | 该物质既能使酸性KMnO4溶液褪色,又能使溴水褪色 | |
| D. | 该物质经加成,加聚后产物是氯丁橡胶(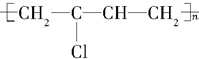 )的主要成分 )的主要成分 |
5.下列关系正确的是( )
| A. | 熔点:正戊烷>2,2一二甲基戊烷>2,3一二甲基丁烷>丙烷 | |
| B. | 密度:CCl4>H2O>苯 | |
| C. | 同质量的物质燃烧耗O2量:丙炔>乙烷>乙烯>乙炔>甲烷 | |
| D. | 同物质的量物质燃烧耗O2量:已烷>环已烷>苯>苯甲酸 |
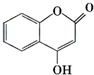 可用来制备抗凝血药,通过下列路线合成:
可用来制备抗凝血药,通过下列路线合成: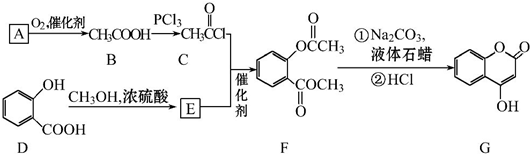
 .
. +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$ +CH3COONa+CH3OH+H2O.
+CH3COONa+CH3OH+H2O. 与
与 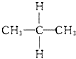
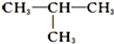
 ;
;