题目内容
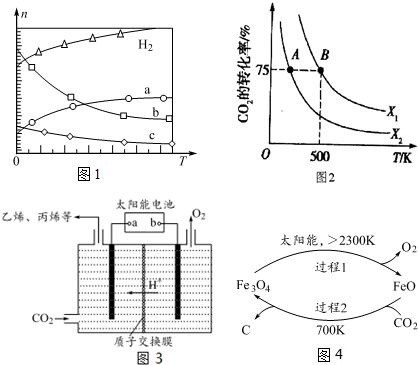
4.如图所示是在一定温度下向不同电解质溶液中加入新物质时其电流强度(I)随新物质加入量(m)的变化曲线.以下三个导电性实验,其中与A图变化趋势一致的是b,与B图变化趋势一致的是a,与C图变化趋势一致的是c.
a.向Ba(OH)2溶液中逐滴加入等浓度的H2SO4至过量
b.向醋酸溶液中逐滴加入等浓度的氨水至过量
c.向盐酸溶液中逐滴加入等浓度的NaOH溶液至过量.
分析 电解质溶液的导电性与离子浓度成正比,与所带电荷成正比,离子浓度越大,溶液导电性越强,据此分析解答.
解答 解:电解质溶液导电性与离子浓度成正比,
a.氢氧化钡溶液中加入等浓度的硫酸至过量,二者反应生成硫酸钡沉淀和水,离子浓度先减小,当二者恰好完全反应时溶液不导电,继续加入稀硫酸,离子浓度增大,溶液导电性增强,所以B符合;
b.醋酸是弱电解质,离子浓度较小,导电性较弱,加入等浓度的氨水,二者反应生成强电解质醋酸铵,离子浓度增大,溶液导电性增强,二者恰好反应后继续滴加氨水,离子浓度变小,导电性变小,所以A符合;
c.向稀盐酸溶液中加入等浓度的NaOH溶液,二者反应生成强电解质氯化钠和弱电解质水,离子浓度减小,溶液导电性减小,当二者完全反应后继续滴加NaOH溶液,当NaOH溶液体积无限增大时溶液浓度相当于NaOH溶液,导电性不变,所以C符合,
故答案为:b;a;c.
点评 本题考查电解质溶液导电性,为高频考点,明确电解质溶液导电性与离子浓度关系及离子之间发生的反应是解本题,侧重考查学生分析判断能力,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.有反应:CO(g)+H2O(g)═CO2(g)+H2(g)△H<0,200℃时该反应的平衡常数K=$\frac{1}{2.25}$.200℃时,将一定量的CO(g)和H2O(g)充入容积为某10L 密闭容器发生上述反应,5min 时达平衡,5min~10min只改变了一个条件,10min 时再次达平衡,各物质浓度(mol/L)变化如下:下列说法正确的是( )
| 0min | 5min | 10min | |
| CO | 0.01 | 0.0056 | |
| H2O | 0.01 | 0.0156 | |
| CO2 | 0 | 0.0044 | |
| H2 | 0 | 0.0044 |
| A. | 0~5min 时用H2O(g)表示的平均反应速率为1.2×10-3 mol/( L.min) | |
| B. | 5min~10min 改变的条件是再加入了0.1mol H2O(g) | |
| C. | 200℃时,若向容器中充入0.01mol CO(g)、0.01mol H2O(g)、0.01molCO2(g)、0.01molH2(g),达平衡时,CO(g)为1.2×10-3mol/L | |
| D. | 300℃时,若向容器中充入0.01mol CO(g)、0.01mol H2O(g)、0.02molCO2(g)、0.02molH2(g),则开始反应时ν(正)<ν(逆) |
12.在下列给定条件的溶液中,一定能大量共存的离子组是( )
| A. | 无色溶液:Al3+、Na+、Cl-、HCO3- | |
| B. | 能使pH试纸呈红色的溶液:Na+、NH4+、Fe3+、NO3- | |
| C. | FeCl3溶液:K+、Na+、NO3-、SCN- | |
| D. | 由水电离出的C(H+)=10-13mol/L的溶液:Na+、K+、SiO32-、NO3- |
19.铝土矿的主要成分是Al2O3、Fe2O3、SiO2等,从铝土矿冶炼Al2O3的流程如图:

下列说法正确的是( )

下列说法正确的是( )
| A. | 气体A一定为HCl | B. | 滤液Ⅰ中溶质可能含NaAlO2 | ||
| C. | 沉淀的主要成分不是硅酸钙 | D. | 反应1、反应2均是氧化还原反应 |
9.进行化学实验时应强化安全意识.下列做法正确的是( )
| A. | 酒精着火时应立即用水灭火 | |
| B. | 实验室制蒸馏水时应在蒸馏烧瓶中放入几粒碎瓷片 | |
| C. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 | |
| D. | 用试管加热碳酸氢钠固体时使试管口竖直向上 |