题目内容
19.铝土矿的主要成分是Al2O3、Fe2O3、SiO2等,从铝土矿冶炼Al2O3的流程如图: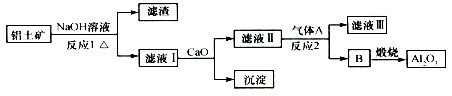
下列说法正确的是( )
| A. | 气体A一定为HCl | B. | 滤液Ⅰ中溶质可能含NaAlO2 | ||
| C. | 沉淀的主要成分不是硅酸钙 | D. | 反应1、反应2均是氧化还原反应 |
分析 SiO2和盐酸不反应,Fe2O3和氢氧化钠不反应而氧化铝能反应,向偏铝酸钠中通入过量的二氧化碳可以生成氢氧化铝沉淀.
铝土矿中加入氢氧化钠溶液,氧化铝和二氧化硅与氢氧化钠反应生成偏铝酸钠和硅酸钠,则滤液Ⅰ为NaAlO2和硅酸钠,加入氢氧化钙,生成硅酸钙沉淀,滤液Ⅱ为偏铝酸钠,可通入二氧化碳气体,生成B为氢氧化铝,煅烧可生成氧化铝,以此解答该题.
解答 解:铝土矿中加入氢氧化钠溶液,氧化铝和二氧化硅与氢氧化钠反应生成偏铝酸钠和硅酸钠,则滤液Ⅰ为NaAlO2和硅酸钠,加入氢氧化钙,生成硅酸钙沉淀,滤液Ⅱ为偏铝酸钠,可通入二氧化碳气体,生成B为氢氧化铝,煅烧可生成氧化铝,
A.气体A应为二氧化碳,故A错误;
B.滤液Ⅰ为NaAlO2和硅酸钠,故B正确;
C.由以上分析可知沉淀为硅酸钙,故C错误;
D.反应2为复分解反应,化合价没有发生变化,不是氧化还原反应,故D错误.
故选B.
点评 本题考查二氧化硅和铝及其化合物的性质,为高频考点,侧重与学生的分析能力和实验能力的考查,把握流程中发生的化学反应为解答的关键,难度不大.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
10.下列有关说法不正确的是( )
| A. | 反应2Mg(s)+CO2(g)=C(s)+2MgO(s)能自发进行,则该反应的△H<0 | |
| B. | 为处理银器表面的黑斑(Ag2S),将银器浸于铝质容器里的食盐水中并与铝接触 | |
| C. | 常温下,将稀CH3COONa溶液加水稀释后,溶液中n(H+)•n(OH-)不变 | |
| D. | 在盛有Ca(OH)2悬浊液的绝热密闭容器中,加入少量的CaO粉末后,溶液中Ca2+数目不变,pH降低 |
7.现有三组实验:
①分离花生油和水
②分离乙二醇和丙三醇.已知乙二醇(C2H6O2)是无色液体,易溶于水和乙醇,沸点198℃.丙三醇(C3H8O3)是无色液体,易溶于水和乙醇,沸点290℃
③用食用酒精浸泡中草药提取其中的有效成份.
正确方法依次是( )
①分离花生油和水
②分离乙二醇和丙三醇.已知乙二醇(C2H6O2)是无色液体,易溶于水和乙醇,沸点198℃.丙三醇(C3H8O3)是无色液体,易溶于水和乙醇,沸点290℃
③用食用酒精浸泡中草药提取其中的有效成份.
正确方法依次是( )
| A. | 分液、蒸馏、分液 | B. | 分液、蒸馏、萃取 | C. | 蒸馏、蒸馏、萃取 | D. | 蒸馏、分液、萃取 |
14.12mL浓度为0.10mol•L-1的Na2SO3溶液,恰好与10mL浓度为0.04mol?L-1的K2Cr2O7溶液完全反应,已知Na2SO3能被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为( )
| A. | +5 | B. | +4 | C. | +3 | D. | +2 |
11.下列关于Fe(OH)3胶体的说法正确的是( )
| A. | Fe(OH)3胶体带正电荷,因此能发生电泳现象 | |
| B. | Fe(OH)3胶体与FeCl3溶液的本质区别是胶体粒子直径在1-100nm之间 | |
| C. | 将FeCl3溶液加入到沸水中能制得Fe(OH)3胶体 | |
| D. | Fe(OH)3胶体和CuSO4溶液都能发生丁达尔现象 |
 (1)同一物质存在气态的熵值最大,液态的熵值次之,固态的熵值最小.若同温同压下,一个反应生成物气体的体积等于反应物气体的体积就可粗略认为该反应的熵变为0.某化学兴趣小组,专门研究了氧族元素及其某些化学物的部分性质.所查资料如下:
(1)同一物质存在气态的熵值最大,液态的熵值次之,固态的熵值最小.若同温同压下,一个反应生成物气体的体积等于反应物气体的体积就可粗略认为该反应的熵变为0.某化学兴趣小组,专门研究了氧族元素及其某些化学物的部分性质.所查资料如下: