题目内容
下列叙述表示可逆反应N2+3H2?2NH3一定处于平衡状态的是( )
| A、N2、H2、NH3的百分含量相等 |
| B、3v(N2)正=v(H2)逆 |
| C、定容容器中,气体的密度不变 |
| D、N2、H2、NH3的浓度之比为1:3:2 |
考点:化学平衡状态的判断
专题:化学平衡专题
分析:化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断,得出正确结论.
解答:
解:A.平衡时各物质的百分含量取决于物质的起始物质的量和转化率,故N2、H2、NH3的百分含量相等不能作为判断是否达到平衡状态的依据,故A错误;
B.3v(N2)正=v(H2)逆,反应速率之比等于化学计量数之比,故正逆反应速率相等,故B正确;
C.密度=
,总质量不变,体积也不变,故气体的密度不变不能作为判断是否达到化学平衡状态的依据,故C错误;
D.平衡时各物质的浓度比值取决于物质的起始物质的量和转化率,故N2、H2、NH3的浓度之比为1:3:2不能作为判断是否达到平衡状态的依据,故D错误,
故选B.
B.3v(N2)正=v(H2)逆,反应速率之比等于化学计量数之比,故正逆反应速率相等,故B正确;
C.密度=
| 总质量 |
| 体积 |
D.平衡时各物质的浓度比值取决于物质的起始物质的量和转化率,故N2、H2、NH3的浓度之比为1:3:2不能作为判断是否达到平衡状态的依据,故D错误,
故选B.
点评:本题考查化学平衡状态的判断,题目难度不大.要注意把握平衡状态的特征.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
某密闭容器中放入一定量的NO2,发生反应2NO2(g)?N2O4(g)(正反应放热),达平衡后,若分别单独改变下列条件,重新达到平衡后,能使混和气体平均分子量增大的是( )
①通入N2 ②通入NO2 ③通入N2O4 ④升高温度.
①通入N2 ②通入NO2 ③通入N2O4 ④升高温度.
| A、①② | B、③④ | C、②③ | D、②④ |
下列说法中,正确的是( )
| A、在纸上层析操作时,要让试样点刚好接触展开剂,否则不能很好地分离 |
| B、实验室制备硝基苯时,先将浓硫酸滴入浓硝酸后,冷却,再边振荡边滴加苯 |
| C、从海带中提取碘的方法是:取样→灼烧→溶解→过滤→萃取 |
| D、向盛有少量Na2O2的试管中加入少量水,并立即滴入2滴酚酞,振荡,溶液呈红色 |
在一个2L的容器中,放入2mol气体A,5分钟后,测得这种气体A还剩余0.5mol,该反应中气体A的化学反应速率是( )
| A、1.5mol/(L?min) |
| B、0.15mol/(L?min) |
| C、0.75mol/(L?min) |
| D、0.075mol/(L?min) |
常温下,下列各溶液的叙述不正确的是( )
| A、pH=7的氨水和氯化铵混合溶液中c(NH4+)=c(Cl-) |
B、浓度均为0.1mol?L-1的 溶液和CH3COONa溶液中,溶液中c( 溶液和CH3COONa溶液中,溶液中c( )<c(CH3COO-) )<c(CH3COO-) |
| C、pH=3的硫酸溶液和pH=11的氨水溶液等体积混合,混合后溶液显碱性 |
| D、已知酸性HF>CH3COOH,则等体积等物质的量浓度的NaF和CH3COONa溶液所含的阴离子数后者较多 |
下列反应中不属于氧化还原反应的是( )
| A、Cl2+2NaOH═NaCl+NaClO+H2O |
| B、NH3+HCl═NH4Cl |
| C、Br2+2KI═I2+2KBr |
| D、CO2+Ca(OH)2═CaCO3+H2O |
在体积不变的400℃恒温密闭容器中,一定量的SO2与1mol O2在催化剂作用下发生反应:2SO2(g)+O2(g)
2SO3(g)+QkJ.当气体的物质的量减少0.5mol时反应达到平衡.下列叙述错误的是( )
| 催化剂 |
| 加热 |
| A、增大氧气浓度,平衡向正方向移动,K值不变 |
| B、降低温度,正反应速率比逆反应速率减小的程度小 |
| C、平衡时SO2气体的转化率为50% |
| D、该条件下反应放出0.5QkJ的热量 |
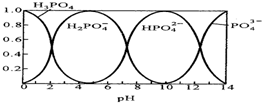 磷酸(H3PO4)在水溶液中各种存在形式物质的量分数δ随pH的变化曲线如图:
磷酸(H3PO4)在水溶液中各种存在形式物质的量分数δ随pH的变化曲线如图: