题目内容
某密闭容器中放入一定量的NO2,发生反应2NO2(g)?N2O4(g)(正反应放热),达平衡后,若分别单独改变下列条件,重新达到平衡后,能使混和气体平均分子量增大的是( )
①通入N2 ②通入NO2 ③通入N2O4 ④升高温度.
①通入N2 ②通入NO2 ③通入N2O4 ④升高温度.
| A、①② | B、③④ | C、②③ | D、②④ |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:能使混合气体平均相对分子质量减小,根据M=
,反应前后质量守恒,n减小即可,应是平衡向正反应方向移动,结合温度、压强对平衡移动的影响解答该题.
| m |
| n |
解答:
解:根据M=
,能使混合气体平均相对分子质量减小,反应前后质量守恒,只要n减小即可,应是平衡向正反应方向移动.
①通入N2,不会引起化学平衡的移动,故错误;
②通入NO2,压强增大,平衡正向移动,n减小,能使混合气体平均相对分子质量增大,故正确;
③通入N2O4 ,压强增大,平衡正向移动,n减小,能使混合气体平均相对分子质量增大,故正确;
④升高温度,平衡逆向移动,n增大,所以使混合气体平均相对分子质量减小,故错误;
故选C.
| m |
| n |
①通入N2,不会引起化学平衡的移动,故错误;
②通入NO2,压强增大,平衡正向移动,n减小,能使混合气体平均相对分子质量增大,故正确;
③通入N2O4 ,压强增大,平衡正向移动,n减小,能使混合气体平均相对分子质量增大,故正确;
④升高温度,平衡逆向移动,n增大,所以使混合气体平均相对分子质量减小,故错误;
故选C.
点评:本题考查化学平衡的影响因素,为高考常见题型和高频考点,注意③项为易错点,不能简单的从平衡移动的角度思考,难度中等.

练习册系列答案
 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案
相关题目
如图实验装置设计,能达到目的是( )
A、 验证乙酸、碳酸和苯酚的酸性强弱 |
B、 实验室制取乙酸丁酯 |
C、 测定乙醇结构式 |
D、 验证溴乙烷中的溴原子 |
在一个不传热的固定容积的密闭容器中,可逆反应N2(气)+3H2(气)?2NH3(气),达到平衡的标志是:①反应速率υ(N2):υ(H2):υ(NH3)=1:3:2;②各组分的物质的量浓度不再改变;③体系的压强不再发生变化;④混合气体的密度不变(相同状况);⑤体系的温度不再发生变化;⑥2υ(N2)(正反应)=υ(NH3)(逆反应)⑦单位时间内3molH-H断键反应同时2molN-H也断键反应( )
| A、①②③⑤⑥ | B、②③④⑤⑥ |
| C、②③④⑥⑦ | D、②③⑤⑥ |
下列叙述表示可逆反应N2+3H2?2NH3一定处于平衡状态的是( )
| A、N2、H2、NH3的百分含量相等 |
| B、3v(N2)正=v(H2)逆 |
| C、定容容器中,气体的密度不变 |
| D、N2、H2、NH3的浓度之比为1:3:2 |
X、Y、Z、W为短周期元素,原子半径X>Y>Z>W,X、Y、Z处于同一周期,Z、W处于同一主族,X、Y、Z最外层电子数之和为10,下列说法正确的是( )
| A、Y的最高价氧化物对应的水化物一定是碱 |
| B、稳定性:W的氢化物>Z的氢化物,沸点:W的氢化物<Z的氢化物 |
| C、若X、Y、W形成的化合物为XYW2,则其水溶液显酸性 |
| D、X、Y的氧化物晶体类型不一定相同 |
常温下,有①氨水 ②NH4Cl溶液 ③Na2CO3溶液 ④NaHCO3溶液各25mL,物质的量浓度均为0.1mol/L,下列说法正确的是( )
| A、四种溶液的pH的大小顺序:①>④>③>② |
| B、将溶液①、②等体积混合所得碱性溶液中:c(NH4+)<c(NH3?H2O) |
| C、向溶液①、②中分别滴加25mL 0.1mol/L盐酸后,溶液中c(NH4+):①>② |
| D、将溶液③、④等体积混合所得溶液中:2 c(OH-)-2c(H+)=3c(H2CO3)+c(HCO3-)-c(CO32-) |
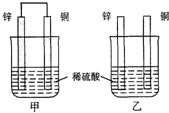 原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献.
原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献. 某课外活动小组用如图装置进行实验,试回答下列问题.
某课外活动小组用如图装置进行实验,试回答下列问题.