题目内容
用水将pH=3的CH3COOH稀释一倍后,溶液的pH为( )
| A、3 | B、3.15 |
| C、3.3 | D、2.7 |
考点:pH的简单计算
专题:电离平衡与溶液的pH专题
分析:CH3COOH为弱酸,pH=3的CH3COOH溶液中氢离子浓度为0.001mol/L,稀释一倍后,由于醋酸电离程度增大,则溶液中氢离子浓度大于:0.001mol/L×
=0.0005mol/L,据此计算出稀释后溶液的pH大小.
| 1 |
| 2 |
解答:
解:pH=3的CH3COOH溶液中氢离子浓度为0.001mol/L,稀释一倍后,醋酸的电离程度增大,则溶液中氢离子浓度大于:0.001mol/L×
=0.0005mol/L,稀释后的溶液的pH小于:-lg0.0005=4-lg5=4-lg10+lg2=3.3,
即稀释后的醋酸溶液的pH介于3-3.3之间,
故选B.
| 1 |
| 2 |
即稀释后的醋酸溶液的pH介于3-3.3之间,
故选B.
点评:本题考查了溶液pH的计算、弱电解质的电离平衡及其影响因素,题目难度不大,注意掌握溶液酸碱性与溶液pH的计算方法,明确稀释过程中弱电解质的电离程度增大.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
下列关系式正确的是( )
A、向Na2S溶液中加水稀释,
| ||
| B、CH3COONH4溶液中:c(NH4+)+c(NH3?H2O)=c(CH3COOH)+c(CH3COO-) | ||
| C、HCO3- 水解的离子方程式为:HCO3-+H2O?CO32-+H3O+ | ||
| D、若除去CuCl2溶液中的杂质FeCl2,应加入CuO后再过滤 |
在K37ClO3+6HCl═KCl+3Cl2↑+3H2O反应中( )
| A、氧化产物与还原产物物质的量比是3:1 | ||
B、被氧化的HCl占参加反应HCl总量的
| ||
| C、K37ClO3只有一部分发生还原反应 | ||
| D、反应完成后37Cl存在于KCl |
 某原电池装置如图所示,盐桥中装有用饱和氯化钾溶液浸泡过的琼脂.原电池工作一段时间后,下列叙述正确的是( )
某原电池装置如图所示,盐桥中装有用饱和氯化钾溶液浸泡过的琼脂.原电池工作一段时间后,下列叙述正确的是( )| A、FeCl2溶液中c(Cl-)会增大 |
| B、原电池装置中的盐桥完全可用金属导线代替 |
| C、铁电极上发生了氧化反应,右边溶液的pH减少 |
| D、电子由Fe电极经导线流向石墨电极,再经稀硫酸、盐桥、FeCl2溶液流回Fe电极 |
下列装置图及有关说法正确的是( )
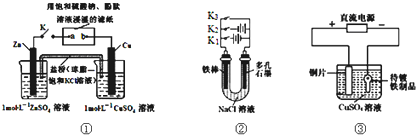

| A、装置①中K键闭合时,片刻后CuSO4溶液中c(Cl-)增大 |
| B、装置①中K键闭合时,片刻后可观察到滤纸a点变红色 |
| C、装置②中铁腐蚀的速度由大到小的顺序是:只闭合K1>只闭合K3>只闭合K2>都断开 |
| D、装置③中当铁制品上析出1.6g铜时,电源负极输出的电子数为0.025NA |
下列说法正确的是( )
| A、1g钠投入100g水中,溶液的总质量为100g |
| B、1g表面被氧化的金属钠投入100g水中,溶液的总质量为101g |
| C、1g氧化钠投入100g水中,溶液的总质量为101g |
| D、1g过氧化钠投入100g水中,溶液的总质量为101g |
同质量的下列烃,分别在氧气中充分燃烧,消耗氧气最多的是( )
| A、甲烷 | B、乙炔 | C、丙烯 | D、甲苯 |