题目内容
 如图是向100毫升的盐酸中,逐渐加入NaOH溶液时,溶液的pH值变化的图象,根据图象所得结论正确的是( )
如图是向100毫升的盐酸中,逐渐加入NaOH溶液时,溶液的pH值变化的图象,根据图象所得结论正确的是( )| A、原来盐酸的物质的量浓度为0.1 mol/L |
| B、X为含0.1 mol的NaOH溶液 |
| C、X为加入了100毫升的NaOH溶液 |
| D、NaOH溶液浓度为0.1 mol/L |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A.氢氧化钠溶液体积为0时溶液的pH=1计算出盐酸溶液的浓度;
B.根据x出氢氧化钠与氯化氢恰好反应及氯化氢的物质的量计算出氢氧化钠溶液的物质的量;
C.没有告诉氢氧化钠溶液浓度,无法计算氢氧化钠溶液的体积;
D.能够计算出x处消耗氢氧化钠溶液的物质的量,但是无法计算出氢氧化钠溶液的体积及浓度.
B.根据x出氢氧化钠与氯化氢恰好反应及氯化氢的物质的量计算出氢氧化钠溶液的物质的量;
C.没有告诉氢氧化钠溶液浓度,无法计算氢氧化钠溶液的体积;
D.能够计算出x处消耗氢氧化钠溶液的物质的量,但是无法计算出氢氧化钠溶液的体积及浓度.
解答:
解:A.滴入NaOH溶液之前,盐酸的pH=1,则盐酸的物质的量浓度为:0.1mol/L,故A正确;
B.100mL该盐酸溶液中含有HCl的物质的量为:0.1mol/L×0.1L=0.01mol,x处氢氧化钠与盐酸恰好反应,根据反应关系式NaOH~HCl可知,氢氧化钠的物质的量为0.01mol,故B错误;
C.题中数据无法求算氢氧化钠溶液的浓度,所以无法计算x出消耗氢氧化钠溶液的体积,故C错误;
D.无法计算x时加入氢氧化钠溶液的体积,只能计算出消耗氢氧化钠的物质的量,无法计算该NaOH溶液的浓度,故D错误;
故选A.
B.100mL该盐酸溶液中含有HCl的物质的量为:0.1mol/L×0.1L=0.01mol,x处氢氧化钠与盐酸恰好反应,根据反应关系式NaOH~HCl可知,氢氧化钠的物质的量为0.01mol,故B错误;
C.题中数据无法求算氢氧化钠溶液的浓度,所以无法计算x出消耗氢氧化钠溶液的体积,故C错误;
D.无法计算x时加入氢氧化钠溶液的体积,只能计算出消耗氢氧化钠的物质的量,无法计算该NaOH溶液的浓度,故D错误;
故选A.
点评:本题考查了酸碱中和滴定及溶液酸碱性与溶液pH的计算,题目难度中等,注意明确溶液酸碱性与溶液pH的计算方法,正确理解图象数据为解答关键,试题侧重培养学生的分析、理解能力,正确分析题中图象是解答本题关键.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
在K37ClO3+6HCl═KCl+3Cl2↑+3H2O反应中( )
| A、氧化产物与还原产物物质的量比是3:1 | ||
B、被氧化的HCl占参加反应HCl总量的
| ||
| C、K37ClO3只有一部分发生还原反应 | ||
| D、反应完成后37Cl存在于KCl |
下列装置图及有关说法正确的是( )
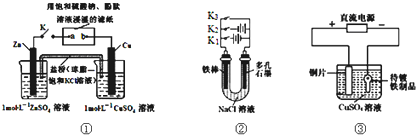

| A、装置①中K键闭合时,片刻后CuSO4溶液中c(Cl-)增大 |
| B、装置①中K键闭合时,片刻后可观察到滤纸a点变红色 |
| C、装置②中铁腐蚀的速度由大到小的顺序是:只闭合K1>只闭合K3>只闭合K2>都断开 |
| D、装置③中当铁制品上析出1.6g铜时,电源负极输出的电子数为0.025NA |
已知某溶液中存在较多的H+、NO3-、SO42-,则该溶液中还可能大量存在的离子组是( )
| A、Na+、Al3+、I- |
| B、NH4+、Cu2+、Cl- |
| C、Mg2+、Cl-、ClO- |
| D、Ba2+、Cl-、Br- |
下列说法正确的是( )
| A、1g钠投入100g水中,溶液的总质量为100g |
| B、1g表面被氧化的金属钠投入100g水中,溶液的总质量为101g |
| C、1g氧化钠投入100g水中,溶液的总质量为101g |
| D、1g过氧化钠投入100g水中,溶液的总质量为101g |
节能减排,作为我国“十一五”规划中一重要任务,已不仅是政府的一个行动目标,而且还能给企业带来经营上的收入,让城市居民能获得一个较好的生存环境.节能减排更是一个人类解决环境问题的必经之路.下列措施和节能减排无关的是( )
| A、将白炽灯换成节能灯 |
| B、发展利用新能源,如太阳能、氢能、核能等 |
| C、大力植树造林,增加绿色植被 |
| D、少开汽车,采取骑自行车或做公交车 |
将0.1mol?L-1HCN溶液与等体积等浓度的NaCN溶液混合,溶液显碱性,下列关系不正确的是( )
| A、c(Na+)>c(CN-)>c(OH-)>c(H+) |
| B、c(CN-)<c(HCN) |
| C、c(CN-)>c(Na+)>c(OH-)>c(H+) |
| D、c(Na+)+c(H+)=c(CN-)+c(OH-) |
下列关于溶液和胶体的叙述中不正确的是( )
| A、一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有 |
| B、在胶体中加入少量电解质溶液时,可能使胶体发生聚沉 |
| C、溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动 |
| D、溶液中溶质粒子直径小于1nm,而胶体粒子直径在1nm~100nm之间 |
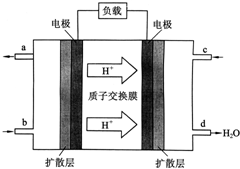 中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.甲醇燃料电池的工作原理如图所示.
中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.甲醇燃料电池的工作原理如图所示.