题目内容
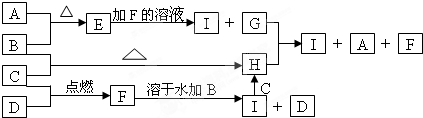
由短周期元素组成的A、B两种盐可发生下列变化,且B的焰色反应呈黄色(图中其它生成物未列出)
(1)无色溶液F中,一定含有的溶质的化学式为 .
(2)写出白色胶状沉淀C转化为无色溶液E的离子方程式 .
(3)A和B的混合物溶于水发生反应的离子方程式 .
(4)A、E两溶液混合反应时,可观察到的现象是 ,写出其反应的离子方程式 .

(1)无色溶液F中,一定含有的溶质的化学式为
(2)写出白色胶状沉淀C转化为无色溶液E的离子方程式
(3)A和B的混合物溶于水发生反应的离子方程式
(4)A、E两溶液混合反应时,可观察到的现象是
考点:无机物的推断
专题:推断题
分析:B的焰色反应呈黄色,应含有钠元素,由题给转化关系可知,C为Al(OH)3,D为CO2,则B为NaHCO3,F为Na2CO3,E为NaAlO2,A为AlCl3,结合对应物质的性质以及题目要求可解答该题.
解答:
解:B的焰色反应呈黄色,应含有钠元素,由题给转化关系可知,C为Al(OH)3,D为CO2,则B为NaHCO3,F为Na2CO3,E为NaAlO2,A为AlCl3,
(1)由上述分析可知,无色溶液F中,一定含有的溶质的化学式为Na2CO3,故答案为:Na2CO3;
(2)白色胶状沉淀C转化为无色溶液E的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(2)A为AlCl3,B为NaHCO3,可发生相互促进水解,反应的离子方程式为:AlO2-+HCO3-+H2O═Al(OH)3↓+CO32-,
故答案为:AlO2-+HCO3-+H2O═Al(OH)3↓+CO32-;
(2)A为AlCl3,E为NaAlO2,二者混合发生水解反应生成氢氧化铝胶状沉淀,B为NaHCO3,F为Na2CO3,反应离子方程式为:3AlO2-+Al3++6H2O═4Al(OH)3↓,
故答案为:有白色胶状沉淀生成;3AlO2-+Al3++6H2O═4Al(OH)3↓.
(1)由上述分析可知,无色溶液F中,一定含有的溶质的化学式为Na2CO3,故答案为:Na2CO3;
(2)白色胶状沉淀C转化为无色溶液E的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(2)A为AlCl3,B为NaHCO3,可发生相互促进水解,反应的离子方程式为:AlO2-+HCO3-+H2O═Al(OH)3↓+CO32-,
故答案为:AlO2-+HCO3-+H2O═Al(OH)3↓+CO32-;
(2)A为AlCl3,E为NaAlO2,二者混合发生水解反应生成氢氧化铝胶状沉淀,B为NaHCO3,F为Na2CO3,反应离子方程式为:3AlO2-+Al3++6H2O═4Al(OH)3↓,
故答案为:有白色胶状沉淀生成;3AlO2-+Al3++6H2O═4Al(OH)3↓.
点评:本题考查无机物的推断为载体,涉及Na、Al化合物的性质,同时考查学生思维能力、推断能力,明确物质的性质是解本题的关键,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列关系式正确的是( )
A、向Na2S溶液中加水稀释,
| ||
| B、CH3COONH4溶液中:c(NH4+)+c(NH3?H2O)=c(CH3COOH)+c(CH3COO-) | ||
| C、HCO3- 水解的离子方程式为:HCO3-+H2O?CO32-+H3O+ | ||
| D、若除去CuCl2溶液中的杂质FeCl2,应加入CuO后再过滤 |
在K37ClO3+6HCl═KCl+3Cl2↑+3H2O反应中( )
| A、氧化产物与还原产物物质的量比是3:1 | ||
B、被氧化的HCl占参加反应HCl总量的
| ||
| C、K37ClO3只有一部分发生还原反应 | ||
| D、反应完成后37Cl存在于KCl |
下列装置图及有关说法正确的是( )
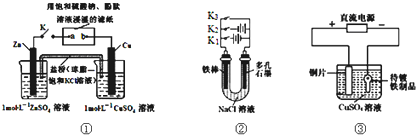

| A、装置①中K键闭合时,片刻后CuSO4溶液中c(Cl-)增大 |
| B、装置①中K键闭合时,片刻后可观察到滤纸a点变红色 |
| C、装置②中铁腐蚀的速度由大到小的顺序是:只闭合K1>只闭合K3>只闭合K2>都断开 |
| D、装置③中当铁制品上析出1.6g铜时,电源负极输出的电子数为0.025NA |
将0.1mol?L-1HCN溶液与等体积等浓度的NaCN溶液混合,溶液显碱性,下列关系不正确的是( )
| A、c(Na+)>c(CN-)>c(OH-)>c(H+) |
| B、c(CN-)<c(HCN) |
| C、c(CN-)>c(Na+)>c(OH-)>c(H+) |
| D、c(Na+)+c(H+)=c(CN-)+c(OH-) |
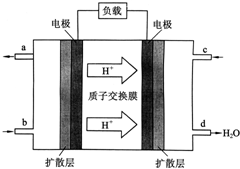 中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.甲醇燃料电池的工作原理如图所示.
中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.甲醇燃料电池的工作原理如图所示.