题目内容
5.硫酸亚铁是一种可用于治疗缺铁性贫血的药剂.硫酸亚铁药片外表包有一层特制的糖衣,以保护硫酸亚铁不被空气中的氧气氧化成硫酸铁(硫酸铁无治贫血的药效).(1)请完成硫酸亚铁在硫酸酸化的条件下与空气中的氧气反应的离子方程式:
4Fe2++1O2+4H+═4Fe3++2 H2O反应中氧化剂是O2(填化学式).
(2)过氧化氢H2O2,(氧的化合价为-1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口,也是绿色氧化剂.对于下列A~D的反应,填写空白:
A.H2O2+Ba(OH)2=BaO2+2H2OB.Ag2O+H2O2=2Ag+O2↑+H2O
C.2H2O2=2H2O+O2↑D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
①H2O2仅体现氧化性的反应是(填代号)D.
②H2O2既体现氧化性又体现还原性的反应是(填代号)C.
③对于B,标况下生成11.2L的O2,则被还原的物质的质量是116g
④上述反应说明H2O2、Ag2O、K2CrO4氧化性由强到弱的顺序是:Ag2O>H2O2>K2CrO4.
(3)除去KCl中的K2CO3,离子方程式是CO32-+2H+=CO2↑+H2O.
分析 (1)在氧化还原反应中,化合价升高数值=化合价降低数值=转移电子数,根据电子守恒配平化学方程式,化合价降低元素所在的反应物是氧化剂;
(2)①②A.H2O2+Ba(OH)2=BaO2+2H2O中各元素化合价不变,所以不属于氧化还原反应;
B.Ag2O+H2O2═2Ag+O2↑+H2O中Ag元素化合价由+1价变为0价、O元素化合价由-1价变为0价,所以氧化银是氧化剂、双氧水是还原剂;
C.2H2O2═2H2O+O2↑中O元素由-1价变为0价和-2价,所以双氧水是氧化剂和还原剂;
D.3H2O2+Cr2(SO4)3+10KOH═2K2CrO4+3K2SO4+8H2O中Cr元素化合价由+3价变为+6价、O元素化合价由-1价变为-2价,所以双氧水是氧化剂,硫酸铬为还原剂,据此分析①②解答;
③根据方程式Ag2O+H2O2=2Ag+O2↑+H2O中氧气计算;
④同一化学反应中,氧化剂的氧化性大于氧化产物的氧化性;
(3)除去KCl溶液和K2CO3的试剂是HCl,碳酸钾和HCl反应生成气体.
解答 解:(1)铁元素化合价从+2价升高到了+3价,升高了一价,氧气的化合价从0价降低到了-2价,生成一分子氧气,降低了4价,所以铁元素的前面乘以系数4,根据电荷守恒,氢离子前边是系数4,水前边系数是2,化合价降低元素是氧元素,所以O2是氧化剂,
故答案为:4;1;4;4;2;O2;
(2)A.H2O2+Ba(OH)2=BaO2+2H2O中各元素化合价不变,所以不属于氧化还原反应;
B.Ag2O+H2O2═2Ag+O2↑+H2O中Ag元素化合价由+1价变为0价、O元素化合价由-1价变为0价,所以氧化银是氧化剂、双氧水是还原剂;
C.2H2O2═2H2O+O2↑中O元素由-1价变为0价和-2价,所以双氧水是氧化剂和还原剂;
D.3H2O2+Cr2(SO4)3+10KOH═2K2CrO4+3K2SO4+8H2O中Cr元素化合价由+3价变为+6价、O元素化合价由-1价变为-2价,所以双氧水是氧化剂,硫酸铬为还原剂,
①H2O2仅体现氧化性的反应是D,故答案为:D;
②H2O2既体现氧化性又体现还原性的反应是C,故答案为:C;
③Ag元素化合价由+1价变为0价,化合价降低,故作Ag2O氧化剂被还原,
Ag2O+H2O2=2Ag+O2↑+H2O
232 22.4
m 11.2
$\frac{232}{m}=\frac{22.4}{11.2}$,m=116,故答案为:116;
④反应Ag2O+H2O2=2Ag+O2↑+H2O中,氧化银做氧化剂,双氧水作还原剂,则氧化性Ag2O>H2O2,反应3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O中,双氧水做氧化剂,铬酸钾做氧化产物,则氧化性H2O2>K2CrO4,故氧化性顺序为:Ag2O>H2O2>K2CrO4,故答案为:Ag2O>H2O2>K2CrO4;
(3)除去KCl溶液和K2CO3的试剂是盐酸,碳酸钾和HCl反应生成气体,离子方程式为CO32-+2H+=CO2↑+H2O,故答案为:CO32-+2H+=CO2↑+H2O.
点评 本题考查氧化还原反应,题目难度不大,注意从元素化合价的角度进行判断,把握氧化还原反应的特征和实质,注意元素化合价的变化.

| A. | 20mL 3mol•L-1Na2S2O3的溶液 | B. | 20mL 2mol•L-1Na2S2O3的溶液 | ||
| C. | 10mL 4mol•L-1Na2S2O3的溶液 | D. | 10mL 2mol•L-1Na2S2O3的溶液 |
(1)石墨和金刚石哪种单质更稳定石墨;
(2)试推测石墨与金刚石各1mol在相同条件下燃烧,金刚石放出的热量多.
| A. | 5s时,正、逆反应速率都达到最大 | |
| B. | 前5s内平均反应速率υ(Y)=0.1 mol/( L•s) | |
| C. | 达平衡时,各物质的浓度都保持不变,反应停止 | |
| D. | 升高温度,测得容器中密度不变时,表示该反应已经达到平衡状态 |
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
(2)己知:常温下,0.1mol/L的某酸H2A的pH=4,则该酸为弱酸(填“强”或“弱”).
H2A的电离方程式为H2A
 H++HA-,该滚液中由水电离出的c(H+)=10-10mol/L.
H++HA-,该滚液中由水电离出的c(H+)=10-10mol/L.(3)25℃时,0.1mol/L的HA溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}=1{0}^{10}$.0.010.1mol/L的BOH溶液pH=12,请回答下列问题:
①HA是弱电解质(填”强电解质”或“弱电解质”,下同).
②在加水稀释HA的过程中,随着水量的增加而减小的是B(填字母).
A.$\frac{c({H}^{+})}{c(HA)}$ B.$\frac{c(HA)}{c({A}^{-})}$ C.(H+)与c(OH-)的乘积 D.c(OH-)
③在体积相等、pH相等的HA溶液与盐酸溶液中加入足量Zn,HA溶液中产生的气体比盐酸中产生的气体多(填“多”“少”或“相等”).
①2P+5CuSO4+8H2O=5Cu+2H3PO4+5H2SO4
②11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4
下列叙述正确的是( )
| A. | 反应①中,氧化剂与还原剂的物质的量之比为2:5 | |
| B. | 反应②中,Cu3P既是氧化产物又是还原产物 | |
| C. | 反应②中,当有5mol CuSO4发生反应时,共转移电子10mol | |
| D. | 反应①中CuSO4做氧化剂,反应②中CuSO4作还原剂 |
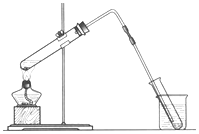 海洋是巨大的资源宝库,从海洋中可获得淡水、单质碘、食盐等物质.
海洋是巨大的资源宝库,从海洋中可获得淡水、单质碘、食盐等物质.(1)如图是用海水制取少量蒸馏水的简易装置,其原理与课本中的实验原理完全相同.装置中使用了较长的玻璃管,其作用是导气冷凝,烧杯中还应盛装的物质是冰水.
(2)海带中含有丰富的碘,海带提碘可将海带灼烧、溶解、煮沸、过滤得含I-的滤液,滤液经酸化、氧化得含单质碘的溶液.回答下列问题:
?海带灼烧时用来盛装海带的仪器是坩埚(填仪器名称)
?已知KMnO4、H2O2、Cl2均可与I-反应生成I2,且KMnO4、H2O2、Cl2对应的生成物分别为Mn2+、H2O、Cl-.从绿色化学的角度将I-转化成I2,最好选择H2O2.
(3)海水晒盐得到的盐含有较多的杂质.某学习小组欲设计实验提纯粗盐.
?①若只除去其中的不溶性杂质,应经过的实验步骤是过滤、洗涤、干燥.
?②若要进一步除去上述粗盐中的可溶性杂质,应选择合理的除杂试剂.请填写表:
| 杂质 | CaCl2 | MgCl2 | Na2SO4 |
| 除杂试剂 | Na2CO3 | NaOH | BaCl2 |
④上述除杂试剂加入的先后顺序应满足的一般条件是Na2CO3溶液应加在BaCl2溶液之后
⑤按顺序加入上述除杂试剂过滤后,还应加入适量稀HCl,其目的是除去过量除杂试剂中的OH-和CO32-.
| A. | 通入过量Cl2:Cl-、Fe2+、SO42-、Al3+ | |
| B. | 加入过量NaOH溶液:Na+、AlO2-、SO42-、OH- | |
| C. | 加入过量氨水:Na+、NH4+、SO42-、AlO2- | |
| D. | 加入过量铜粉:NO3-、Fe3+、SO42-、Al3+ |