题目内容
1.正常情况下,大气中含有约78%的N2,21%的O2,还含有少量的CO2、水蒸气以及稀有气体和杂质.如果大气中CO2的含量明显增加,就会引起“温室效应”,导致全球变暖.(1)CO2是共价化合物,它的电子式可表示为
 .
.(2)实验室中检验CO2气体最方便的方法是将CO2气体通入饱和的澄清石灰水中,产生的实验现象是变浑浊,相应的反应方程式为CO2+Ca(OH)2═CaCO3↓+H2O.
(3)在宇宙飞船和太空站上工作的宇航员,在密闭的工作舱内需要吸入O2,呼出CO2,飞船内可以使用一种物质,它能吸收CO2并产生O2,该物质是Na2O2,其反应方程式为2CO2+2Na2O2═2Na2CO3+O2.
分析 (1)二氧化碳分子中含有两个碳氧双键,C、O原子最外层都达到8电子稳定结构;
(2)氢氧化钙与二氧化碳生成碳酸钙沉淀,溶液会变浑浊;
(3)过氧化钠与二氧化碳反应生成碳酸钠和氧气,据此可以为宇航员提供氧气.
解答 解:(1)CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子,其电子式为 ,
,
故答案为: ;
;
(2)将CO2气体通入饱和的澄清石灰水中生成碳酸钙沉淀,溶液变浑浊,据此可检验CO2气体,反应的化学方程式为:CO2+Ca(OH)2═CaCO3↓+H2O,
故答案为:变浑浊; CO2+Ca(OH)2═CaCO3↓+H2O;
(3)飞船内可以使用一种物质,它能吸收CO2并产生O2,该物质为Na2O2,反应的化学方程式为:2CO2+2Na2O2═2Na2CO3+O2,
故答案为:Na2O2;2CO2+2Na2O2═2Na2CO3+O2.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、化学方程式的书写,明确书写原则为解答关键,试题有利于提高学生的规范答题能力.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
8.下列化学用语错误的是( )
| A. | 氯化氢分子的电子式: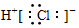 | B. | 乙烯的最简式:CH2 | ||
| C. | 苯的分子式:C6H6 | D. | 氯的原子结构示意图: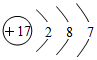 |
12.H2是重要的化工原料,在工业生产和科学研究中具有重要地位,回答下列问题:
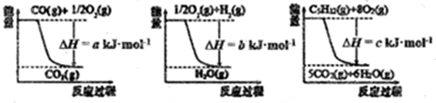
(1)如何获得廉价的氢气是合成氨工业中的重要课题.目前常用戊烷跟水蒸气反应的方法获得氨气:
C5H12(g)+5H2O(g)$\frac{\underline{\;催化剂\;}}{高温}$5CO(g)+11H2(g)
已知几个反应的能量变化如图所示,则上述反应的△H=c-5a-11bkJ•mol-1.
(2)利用氢气合成氨的反应原理为:3H2(g)+N2(g)$\frac{\underline{\;高温、高压\;}}{催化剂}$2NH3(g)现有甲、乙、丙3个固定容积为2L的密闭容器,在相同温度和催化剂条件下,按不同的反应物投入量进行合成氨反应,相关数据如下表示:
①下列描述不能说明该反应已达到平衡状态的是a(填序号)
a.容器内混合气体的密度保持不变
b.3v 正(N2)=v 逆(H2)
c.容器内混合气体的平均相对分子质量保持不变
②乙容器中的反应在20min后达到平衡,这段时间内NH3的平均反应速率v(NH3)=0.05mol•L-1•min-1,该温度下,反应的平衡常数K=5.33L2•mol-2(结果保留3位有效数字);
③分析上表中的数据,下列关系正确的是ac(填序号).
a.c1>c3 b.w 1<w 2 c.ρ2>ρ1>ρ3???????
④在合成氨工业中,为了提高反应物的利用率,除了要提供适宜的温度、压强和使用催化剂外,还要采取的措施是将产物混合气中的氨冷却分离后,剩余气体循环使用.
(3)一定条件下存在反应:H2(g)+I2(g)?2HI(g)△H<0,现有甲、乙两个完全相同的恒容绝热密闭容器,在甲中充入1molH2和1molI2(g),在乙中充入2molHI(g).同时在700℃条件下开始反应,达到平衡时有关说法正确的是
①容器甲中气体的正反应速率比容器乙中的快(填“快”、“慢”或“相同”)
②容器甲中气体的平衡常数比容器乙中的小(填“大”、“小”或“相等”)
③容器甲中气体的颜色比容器乙中的深(填“深”、“浅”或“相同”)
(1)如何获得廉价的氢气是合成氨工业中的重要课题.目前常用戊烷跟水蒸气反应的方法获得氨气:
C5H12(g)+5H2O(g)$\frac{\underline{\;催化剂\;}}{高温}$5CO(g)+11H2(g)
已知几个反应的能量变化如图所示,则上述反应的△H=c-5a-11bkJ•mol-1.

(2)利用氢气合成氨的反应原理为:3H2(g)+N2(g)$\frac{\underline{\;高温、高压\;}}{催化剂}$2NH3(g)现有甲、乙、丙3个固定容积为2L的密闭容器,在相同温度和催化剂条件下,按不同的反应物投入量进行合成氨反应,相关数据如下表示:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2molH2、2molN2 | 4molH2、4molN2 | 2molNH3 |
| 平衡时N2的浓度(mol•L-1) | c1 | 1.5 | C3 |
| N2的体积分数 | w 1 | w 2 | w 3 |
| 混合气体的密度(g•L-1) | ?ρ1 | ?ρ2 | ?ρ3? |
a.容器内混合气体的密度保持不变
b.3v 正(N2)=v 逆(H2)
c.容器内混合气体的平均相对分子质量保持不变
②乙容器中的反应在20min后达到平衡,这段时间内NH3的平均反应速率v(NH3)=0.05mol•L-1•min-1,该温度下,反应的平衡常数K=5.33L2•mol-2(结果保留3位有效数字);
③分析上表中的数据,下列关系正确的是ac(填序号).
a.c1>c3 b.w 1<w 2 c.ρ2>ρ1>ρ3???????
④在合成氨工业中,为了提高反应物的利用率,除了要提供适宜的温度、压强和使用催化剂外,还要采取的措施是将产物混合气中的氨冷却分离后,剩余气体循环使用.
(3)一定条件下存在反应:H2(g)+I2(g)?2HI(g)△H<0,现有甲、乙两个完全相同的恒容绝热密闭容器,在甲中充入1molH2和1molI2(g),在乙中充入2molHI(g).同时在700℃条件下开始反应,达到平衡时有关说法正确的是
①容器甲中气体的正反应速率比容器乙中的快(填“快”、“慢”或“相同”)
②容器甲中气体的平衡常数比容器乙中的小(填“大”、“小”或“相等”)
③容器甲中气体的颜色比容器乙中的深(填“深”、“浅”或“相同”)
16.把下列4种Na2S2O3的溶液分别加入4个盛有10mL 2mol•L-1硫酸的烧杯中,均加水稀释到50mL,此时,Na2S2O3和硫酸进行反应.其中出现沉淀最快的是( )
| A. | 20mL 3mol•L-1Na2S2O3的溶液 | B. | 20mL 2mol•L-1Na2S2O3的溶液 | ||
| C. | 10mL 4mol•L-1Na2S2O3的溶液 | D. | 10mL 2mol•L-1Na2S2O3的溶液 |
13.已知在高温、高压、催化剂作用下,石墨可转化为金刚石,并吸收1.9KJ/mol的热量.
(1)石墨和金刚石哪种单质更稳定石墨;
(2)试推测石墨与金刚石各1mol在相同条件下燃烧,金刚石放出的热量多.
(1)石墨和金刚石哪种单质更稳定石墨;
(2)试推测石墨与金刚石各1mol在相同条件下燃烧,金刚石放出的热量多.
10.(1)根据最新“人工固氮”的研究报道,在常温、光照条件下,N2在催化剂(掺有少最Fe2O3的TiO2)表面与水发生下列反应:N2(g)+3H2O(g)?2NH3(g)+$\frac{3}{2}$O2(g)△H=aJ/mol,进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如表:
此合成反应的a>0;△s>0(填“>”、“<”或“=”)
(2)己知:常温下,0.1mol/L的某酸H2A的pH=4,则该酸为弱酸(填“强”或“弱”).
H2A的电离方程式为H2A H++HA-,该滚液中由水电离出的c(H+)=10-10mol/L.
H++HA-,该滚液中由水电离出的c(H+)=10-10mol/L.
(3)25℃时,0.1mol/L的HA溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}=1{0}^{10}$.0.010.1mol/L的BOH溶液pH=12,请回答下列问题:
①HA是弱电解质(填”强电解质”或“弱电解质”,下同).
②在加水稀释HA的过程中,随着水量的增加而减小的是B(填字母).
A.$\frac{c({H}^{+})}{c(HA)}$ B.$\frac{c(HA)}{c({A}^{-})}$ C.(H+)与c(OH-)的乘积 D.c(OH-)
③在体积相等、pH相等的HA溶液与盐酸溶液中加入足量Zn,HA溶液中产生的气体比盐酸中产生的气体多(填“多”“少”或“相等”).
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
(2)己知:常温下,0.1mol/L的某酸H2A的pH=4,则该酸为弱酸(填“强”或“弱”).
H2A的电离方程式为H2A
 H++HA-,该滚液中由水电离出的c(H+)=10-10mol/L.
H++HA-,该滚液中由水电离出的c(H+)=10-10mol/L.(3)25℃时,0.1mol/L的HA溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}=1{0}^{10}$.0.010.1mol/L的BOH溶液pH=12,请回答下列问题:
①HA是弱电解质(填”强电解质”或“弱电解质”,下同).
②在加水稀释HA的过程中,随着水量的增加而减小的是B(填字母).
A.$\frac{c({H}^{+})}{c(HA)}$ B.$\frac{c(HA)}{c({A}^{-})}$ C.(H+)与c(OH-)的乘积 D.c(OH-)
③在体积相等、pH相等的HA溶液与盐酸溶液中加入足量Zn,HA溶液中产生的气体比盐酸中产生的气体多(填“多”“少”或“相等”).
 磷化氢气体(PH3)是一种强烈的储粮害虫杀剂,其制取原理类似于实验室制氨气,空气中磷化氢气体达到2PPM以上是就会造成人畜中毒,请回答:
磷化氢气体(PH3)是一种强烈的储粮害虫杀剂,其制取原理类似于实验室制氨气,空气中磷化氢气体达到2PPM以上是就会造成人畜中毒,请回答: