题目内容
20.铝及其化合物在生产、生活等方面有广泛的应用.(1)铝元素位于周期表中第三周期ⅢA族.硼、镓与铝位于同一主族,现有下列三种物质:①Na[Al(OH)4]、②Na[B(OH)4]、③Na[Ga(OH)2],浓度相同的这三种物质的溶液pH由大到小的顺序为③>①>②(用序号表示).{Na[Al(OH)4]也可表示偏铝酸钠,硼、镓类似}
(2)将20.0mL 0.1mol/L Ba(OH)2溶液和20.0mL 0.1mol/L NH4A1(SO4)2溶液混合,所得溶液中Al3+、NH4+、SO42-、OH-、H+的浓度由大到小的顺序为c(SO42-)>c(NH4+)>c(Al3+)>c(H+)>c(OH-).
(3)氮化铝(A1N)是一种新型的无机非金属材料,可用作热交换器材料.某A1N样品中仅含有A12O3杂质,为测定A1N的含量,甲组同学设计了如图流程:
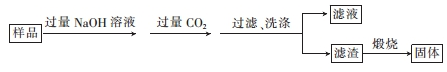
已知:AlN+NaOH+H2O=NaAlO2+NH3↑.
①过滤时用到的玻璃仪器有烧杯、漏斗和玻璃棒.
②实验过程中,称得样品的质量为4.2g,最后得到的固体为5.1g,则样品中A1N的质量分数为97.62%.(不考虑整个过程中的损耗)
分析 (1)对于主族元素,周期数=电子层数,族序数=最外层电子数.据此判断该元素在周期表中位置;根据同主族元素原子序数越大,金属性越强,其对应的盐碱性越强;
(2)将20.0mL 0.1mol/L Ba(OH)2溶液和20.0mL 0.1mol/L NH4A1(SO4)2溶液混合,即两者等物质的量混合,所以2mmol的硫酸钡和$\frac{4}{3}$mmol的氢氧化铝,所以溶液中含有2mmol的硫酸根离子,2mmol的铵根离子和$\frac{2}{3}$mmol的铝离子,弱离子铵根离子和铝离子的水解溶液呈酸性;
(3)①过滤时用到的玻璃仪器有烧杯、漏斗和玻璃棒;
②煅烧得氧化铝,根据铝守恒分析得:2A1N~~A12O3,由关系式求氮化铝的质量,然后代入质量分数进行计算.
解答 解:(1)原子序数为13的元素,质子数为13,核外电子数为13,有3个电子层,最外层有3个电子,位于周期表中第三周期第ⅢA族;同主族元素原子序数越大,金属性越强,其对应的盐溶液碱性越强,镓、硼与铝位于同一主族,金属性镓>铝>硼,故碱性Na[Ga(OH)4]>Na[A1(OH)4]>Na[B(OH)4],故答案为:三;ⅢA;③>①>②;
(2)将20.0mL 0.1mol/L Ba(OH)2溶液和20.0mL 0.1mol/L NH4A1(SO4)2溶液混合,即两者等物质的量混合,所以2mmol的硫酸钡和$\frac{4}{3}$mmol的氢氧化铝,所以溶液中含有2mmol的硫酸根离子,2mmol的铵根离子和$\frac{2}{3}$mmol的铝离子,弱离子铵根离子和铝离子的水解溶液呈酸性,所以离子浓度的大小为:c(SO42-)>c(NH4+ )>c(Al3+)>c(H+)>c(OH-),故答案为:c(SO42-)>c(NH4+ )>c(Al3+)>c(H+)>c(OH-);
(3)①过滤时用到的玻璃仪器有烧杯、漏斗和玻璃棒,故答案为:玻璃棒;
②煅烧得氧化铝,根据铝守恒分析得:2A1N~~A12O3,
2×(27+14)102
m(A1N) 5.1g
所以$\frac{2×(27+14)}{m(AlN)}=\frac{102}{5.1g}$,解之得:m(A1N)=4.1g,则样品中A1N的质量分数为 $\frac{4.1g}{4.2g}×100%$=97.62%,
答:样品中A1N的质量分数为97.62%.
点评 此题是盐水解程度和利用化学方程式计算相结合的题目以及离子浓度大小的,难度中等,该题步骤较多,应认真分析,另外要掌握关系法的应用.

(1)石墨和金刚石哪种单质更稳定石墨;
(2)试推测石墨与金刚石各1mol在相同条件下燃烧,金刚石放出的热量多.
 海洋是巨大的资源宝库,从海洋中可获得淡水、单质碘、食盐等物质.
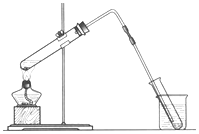
海洋是巨大的资源宝库,从海洋中可获得淡水、单质碘、食盐等物质.(1)如图是用海水制取少量蒸馏水的简易装置,其原理与课本中的实验原理完全相同.装置中使用了较长的玻璃管,其作用是导气冷凝,烧杯中还应盛装的物质是冰水.
(2)海带中含有丰富的碘,海带提碘可将海带灼烧、溶解、煮沸、过滤得含I-的滤液,滤液经酸化、氧化得含单质碘的溶液.回答下列问题:
?海带灼烧时用来盛装海带的仪器是坩埚(填仪器名称)
?已知KMnO4、H2O2、Cl2均可与I-反应生成I2,且KMnO4、H2O2、Cl2对应的生成物分别为Mn2+、H2O、Cl-.从绿色化学的角度将I-转化成I2,最好选择H2O2.
(3)海水晒盐得到的盐含有较多的杂质.某学习小组欲设计实验提纯粗盐.
?①若只除去其中的不溶性杂质,应经过的实验步骤是过滤、洗涤、干燥.
?②若要进一步除去上述粗盐中的可溶性杂质,应选择合理的除杂试剂.请填写表:
| 杂质 | CaCl2 | MgCl2 | Na2SO4 |
| 除杂试剂 | Na2CO3 | NaOH | BaCl2 |
④上述除杂试剂加入的先后顺序应满足的一般条件是Na2CO3溶液应加在BaCl2溶液之后
⑤按顺序加入上述除杂试剂过滤后,还应加入适量稀HCl,其目的是除去过量除杂试剂中的OH-和CO32-.
单质$\stackrel{O_{2}}{→}$氧化物$\stackrel{+H_{2}O}{→}$酸或碱$\stackrel{+NaOH或HCl}{→}$盐.
| A. | 硅 | B. | 硫 | C. | 铝 | D. | 铁 |
| A. | 次氯酸的电子式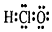 | B. | 二氧化硅的分子式:SiO2 | ||
| C. | 中子数为18的铝原子:1735Cl | D. | 钠离子的结构示意图: |
| A. | 通入过量Cl2:Cl-、Fe2+、SO42-、Al3+ | |
| B. | 加入过量NaOH溶液:Na+、AlO2-、SO42-、OH- | |
| C. | 加入过量氨水:Na+、NH4+、SO42-、AlO2- | |
| D. | 加入过量铜粉:NO3-、Fe3+、SO42-、Al3+ |
| A. | 仅HCl | B. | 只有HCl和HClO | C. | 只有HCl和Cl2 | D. | HCl、HClO和Cl2 |
N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2N2O5(g) 4NO2(g)+O2(g) △H>0一定温度时,向密闭容器中通入N2O5,部分实验数据见下表:
4NO2(g)+O2(g) △H>0一定温度时,向密闭容器中通入N2O5,部分实验数据见下表:
时间/s[K] | 0 | 500 | 1000 | 1500 |
c(N2O5)/mol/L | 0.50 | 0.35 | 0.25 | 0.25 |
下列说法中错误的是
A.500 s时O2的浓度为0.075 mol/L
B.平衡后,升高温度,正反应速率先增大后减小
C.平衡后,要使平衡常数增大,改变的条件是升高温度
D.1000 s时将容器的体积缩小一半,重新达到平衡时0.25 mol/L<c(N2O5)<0.50 mol/L