题目内容
2.A、B、C三种常见的短周期元素可以形成AB2、C2B、AB3、C2B2、B2等物质.已知B离子和C离子有相同的电子层结构,A离子比B离子多一个电子层,请回答:(1)化合物C2B2的化学键类型为离子键和共价键.
(2)用电子式表示C2B的形成过程
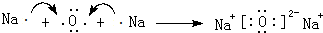 .
.(3)AB3的水化物在低温下跟C2B2反应生成一种稳定性较差的过氧化物,该反应的化学方程式是H2SO4+Na2O2=Na2SO4+H2O2.
(4)AB3的水化物溶液跟C2A溶液反应的离子方程式是2H++S2-=H2S↑,此反应物之一跟AB2反应的化学方程式是2H2S+SO2=3S↓+2H2O.
分析 B离子和C离子有相同的电子层结构,二者可以形成C2B,说明B是第二周期元素,C是第三周期元素,所以B是O,C是Na;由于A离子比B离子多一个电子层,且可以形成AB2、AB3,所以A是S元素,以此解答该题.
解答 解:B离子和C离子有相同的电子层结构,二者可以形成C2B,说明B是第二周期元素,C是第三周期元素,所以B是O,C是Na;由于A离子比B离子多一个电子层,且可以形成AB2、AB3,所以A是S元素
(1)C2B2为Na2O2,含有离子键和共价键,故答案为:离子键和共价键;
(2)用电子式表示Na2O的形成过程为: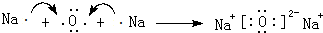 ,
,
故答案为: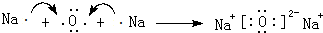 ;
;
(3)SO3的水化物为硫酸,在低温下跟Na2O2反应生成一种稳定性较差的过氧化物,该过氧化物为过氧化物,该反应的化学方程式是H2SO4+Na2O2=Na2SO4+H2O2,
故答案为:H2SO4+Na2O2=Na2SO4+H2O2;
(4)SO3的水化物溶液为硫酸,跟Na2S溶液反应的离子方程式是:2H++S2-=H2S↑,此反应物之一跟SO2反应的化学方程式是:2H2S+SO2=3S↓+2H2O,
故答案为:2H++S2-=H2S↑;2H2S+SO2=3S↓+2H2O.
点评 本题考查元素周期表的结构以及元素周期律的应用,是高考中的常见题型,属于中等难度,解题的关键是掌握第1~18号元素名称和符号,元素同期表的结构,能根据元素同期律进行分析推断,有利于考查学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.下列实验方案能达到实验目的是( )
| 实验目的 | 实验方案 | |
| A | 证明溴乙烷发生消去反应有 乙烯生成 | 向试管中加入适量的溴乙烷和NaOH的乙醇溶液, 加热,将反应产生的气体通入溴的四氯化碳溶液 |
| B | 证明HCOOH结构中含有醛 基 | 将1mL 1mol/L HCOOH溶液加入装有银氨溶液 的试管中并水浴加热,观察有无银镜产生 |
| C | 除去甲烷中的乙烯 | 将混合气通入KMnO4溶液中洗气 |
| D | 制取乙烯气体 | 将无水乙醇和浓硫酸混合加热到140℃ |
| A. | A | B. | B | C. | C | D. | D |
15.下列叙述正确的是( )
| A. | H2O的摩尔质量为18g | |
| B. | 3.01×1023个SO2分子的质量为32g | |
| C. | 标准状况下,1 mol任何物质体积均为22.4L | |
| D. | 将0.1mol NH3溶于1L水,配成溶液中溶质的物质的量浓度为0.1mol/L |
12.欲除去Cl2中的少量HCl气体,可选用( )
| A. | NaOH溶液 | B. | AgNO3溶液 | C. | 饱和食盐水 | D. | 石灰水 |
19.下列混合物可用加热法分离的是( )
| A. | 碘、氯化铵 | B. | 氯化铵、硫酸钡 | C. | 硫化钠、氯酸钾 | D. | 氯化钠、硫酸钠 |
7.决定化学反应速率的最主要因素是( )
| A. | 反应物浓度 | B. | 反应温度 | ||
| C. | 反应物自身的性质 | D. | 是否使用催化剂 |
14.下列各组物质在一定条件下,可制得较纯净的1,2-二氯乙烷的是( )
| A. | 乙烷与氯气混合 | B. | 乙烯与氯化氢混合 | ||
| C. | 乙烯与氯气混合 | D. | 乙炔与氯气混合 |
11.下列说法正确的是( )
| A. | 煤的干馏和煤的液化均是物理变化 | |
| B. | 船体镀锌或锡均可保护船体,镀层破损后将立即失去保护作用 | |
| C. | 由于共价键具有方向性,共价化合物在形成晶体时均采取“紧密堆积” | |
| D. | 反应NH4Cl (s)═NH3(g)+HCl(g)室温下不能自发进行,则该反应的△H>0 |
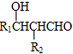
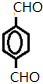 +4Ag(NH3)2OH$\stackrel{水浴}{→}$
+4Ag(NH3)2OH$\stackrel{水浴}{→}$ +4Ag↓+6NH3+2H2O.
+4Ag↓+6NH3+2H2O. .
.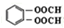 .
.