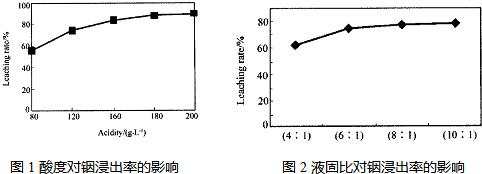
题目内容
19.下列混合物可用加热法分离的是( )| A. | 碘、氯化铵 | B. | 氯化铵、硫酸钡 | C. | 硫化钠、氯酸钾 | D. | 氯化钠、硫酸钠 |
分析 可用加热法分离,两种物质中只有一种物质易升华或易分解,而另一种物质加热不发生变化,以此来解答.
解答 解:A.加热碘升华,氯化铵分解,则加热法不能分离,故A不选;
B.氯化铵加热分解,硫酸钡不变化,加热可分离,故B选;
C.加热时硫化钠、氯酸钾发生氧化还原反应,不能分离,故C不选;
D.加热均无变化,不能分离,故D不选;
故选B.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异、发生的反应及混合物分离方法为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.已知:2H2(g)+O2(g)═2H2O(g)1molH2完全燃烧放出热量为241.8KJ有关键能数据如表:
则H-H键键能为( )
| 化学键 | H-O | O=O |
| 键能/KJ?mol-1 | 463.4 | 498 |
| A. | 413KJ/mol | B. | 872KJ/mol | C. | 221.6KJ/mol | D. | 436KJ/mol |
7.下列说法中正确的是( )
| A. | 氢元素有三种同位素,则氢气分子有三种 | |
| B. | 稀有气体元素原子最外层都达到8电子稳定结构 | |
| C. | 第IA、ⅡA族元素的阳离子与同周期稀有气体元素原子具有相同的核外电子排布 | |
| D. | 将盛有NH4HCO3粉末的小烧杯放人盛有少量醋酸的大烧杯中,然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固,该反应中,热能转化为产物内部的能量 |
14.对于反应4FeS2(s)+11O2(g)$\frac{\underline{\;高温\;}}{\;}$2Fe2O3(s)+8SO2(g),改变下列条件不会影响反应速率的是( )
| A. | 增大压强 | B. | 不断鼓入空气 | C. | 加入FeS2 | D. | 升高温度 |
9.下列化合物分子中的所有原子都处于同一平面的是( )
| A. | 甲烷 | B. | 对二甲苯 | C. | 氯乙烯 | D. | 丙烯 |
6.硅是重要的半导体材料,构成了现代电子工业的基础.请回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9、电子数为4.
(2)硅主要以硅酸盐、二氧化硅等化合物的形式存在于地壳中.
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以共价键相结合,其晶胞中共有8个原子,其中在面心位置贡献3个原子.
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备.工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为Mg2Si+4NH4Cl=SiH4+4NH3+2MgCl2.
(5)碳和硅的有关化学键键能如表所示,简要分析和解释下列有关事实:
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是C-C键和C-H键较强,所形成的烷烃稳定,而硅烷中Si-Si键和Si-H键的键能较低,易断裂,导致长链硅烷难以生成.
②SiH4的稳定性小于CH4,更易生成氧化物,原因是C-H键的键能大于C-O键,C-H键比C-O键稳定,而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键.
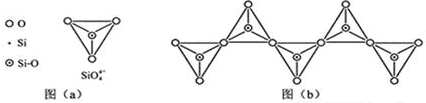
(6)在硅酸盐中,SiO44-四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为sp3,Si与O的原子数之比为1:3,化学式为SiO32-.
(1)基态Si原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9、电子数为4.
(2)硅主要以硅酸盐、二氧化硅等化合物的形式存在于地壳中.
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以共价键相结合,其晶胞中共有8个原子,其中在面心位置贡献3个原子.
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备.工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为Mg2Si+4NH4Cl=SiH4+4NH3+2MgCl2.
(5)碳和硅的有关化学键键能如表所示,简要分析和解释下列有关事实:
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
| 键能/(kJ•mol-1 | 356 | 413 | 336 | 226 | 318 | 452 |
②SiH4的稳定性小于CH4,更易生成氧化物,原因是C-H键的键能大于C-O键,C-H键比C-O键稳定,而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键.
(6)在硅酸盐中,SiO44-四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为sp3,Si与O的原子数之比为1:3,化学式为SiO32-.

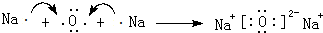 .
.