题目内容
3.我国青海查尔汗盐湖蕴藏丰富的盐业资源.经分析知道该湖水中含有高浓度的Na+、K+、Mg2+及Cl-等.利用盐湖水可得到某些物质.其主要工业流程如下: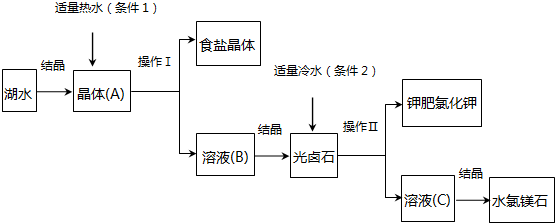
请根据上述流程,回答下列问题:
(1)利用湖水得到晶体(A)的方法是蒸发结晶法(填“降温”或“蒸发”).
(2)操作Ⅰ的名称为过滤,此操作适用于分离不溶于液体的固体和液体.
(3)本流程中分别采用条件1和条件2获得不同晶体,所依据的物理量是b.
a.摩尔质量b.溶解度c.熔沸点
(4)检验钾肥中是否含有Na+的实验方法是焰色反应,若含有Na+,能观察到的现象是火焰呈黄色.若需得到高纯度的钾肥,可以采用的提纯方法为重结晶法.
(5)水氯镁石的化学式可表示为MgCl2•xH2O,若通过实验确定χ,其实验步骤设计为:
①先称坩埚质量、再称坩埚和样品质量;②高温充分灼烧;③冷却;
④再称量;⑤恒重操作.
根据实验数据计算x时,所需的化学方程式为:MgCl2•xH2O$\stackrel{高温}{→}$MgO+2HCl+(x-1)H2O.
分析 湖水中含有高浓度的Na+、K+、Mg2+及Cl-等,氯化钠的溶解度受温度影响不大,通过蒸发结晶得到晶体A,通过过滤得到食盐晶体和溶液B,溶液B中含大量K+、Mg2+及Cl-,氯化钾的溶解度受温度影响较大,通加入冷水冷却结晶,再次过滤得到得到钾肥氯化钾晶体和溶液C,溶液C中含大量Mg2+及Cl-,最后蒸发浓缩、冷却结晶得到水氯镁石.
(1)根据得到的晶体A主要是氯化钠,氯化钠的溶解度受温度影响变化较小进行分析;
(2)根据过滤可以将溶液和固体分离分析;
(3)根据物质溶解度的不同,可以采用不同的方法将溶液中的溶质进行分离;
(4)钠元素的焰色反应呈黄色,重结晶可以使不纯净的物质获得纯化;
(5)根据水氯镁石在高温的条件下反应生成氧化镁、水和盐酸写出方程式;结晶水的测定实验步骤为称量、加热、冷却、称量,操作要重复进行,直至连续两次称量的差不超过0.1g为止.
解答 解:湖水中含有高浓度的Na+、K+、Mg2+及Cl-等,氯化钠的溶解度受温度影响不大,通过蒸发结晶得到晶体A,通过过滤得到食盐晶体和溶液B,溶液B中含大量K+、Mg2+及Cl-,氯化钾的溶解度受温度影响较大,通加入冷水冷却结晶,再次过滤得到得到钾肥氯化钾晶体和溶液C,溶液C中含大量Mg2+及Cl-,最后蒸发浓缩、冷却结晶得到水氯镁石.
(1)得到的晶体A主要是氯化钠,氯化钠的溶解度受温度影响变化较小,所以得到晶体A的方法是蒸发结晶,故答案为:蒸发;
(2)过滤可以将溶液和固体分离,所以操作Ⅰ的名称为过滤,故答案为:过滤;不溶于液体的固体和液体;
(3)本流程中分别采用条件1和条件2获得不同晶体,所依据是物质的溶解度,故答案为:b;
(4)钠离子用焰色反应进行检验,火焰呈黄色,要得到较高纯度的钾肥,利用钾盐和钠盐在水中不同温度时的溶解度不同而使它们相互分离,这种方法叫重结晶,故答案为:焰色反应;火焰呈黄色;重结晶;
(5)水氯镁石在高温的条件下反应,镁离子水解生成氢氧化镁,且产生的氯化氢不断挥发,使水解彻底,氢氧化镁灼烧后分解得到氧化镁,所以水氯镁石分解生成氧化镁、水和盐酸,化学方程式为:MgCl2•xH2O$\frac{\underline{\;高温\;}}{\;}$MgO+2HCl+(x-1)H2O;
结晶水的测定实验步骤为:①称量:称量坩埚质量,再称坩埚和晶体样品的总质量;
②加热灼烧:使晶体MgCl2•xH2O完全转化为MgO为止;
③冷却:将坩埚放在干燥器里冷却;
④称量:称量坩埚和MgO的总质量;
⑤重复②③④操作,若再次称量的坩埚和MgO的总质量与第一次的差小于0.1g,则实验成功;若大于0.1g,必须再重复②③④操作,也叫做恒重操作,直至两次的差小于0.1g为止,取平均值,
故答案为:坩埚和样品;冷却;恒重;MgO;2HCl;(x-1)H2O.
点评 本题考查物质分离和提纯的方法、基本操作综合应用以及结晶水含量的测定,题目难度不大,注意把握物质性质进行解答.

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案| 选项 | 实验操作 | 现象 | 结论 |
| A | 将SO2通入酸性高锰酸钾溶液 | 高锰酸钾溶液紫色褪色 | SO2具有漂白性 |
| B | 向某溶液中滴加KSCN溶液 | 溶液显红色 | 原溶液中有Fe3+无Fe2+ |
| C | 将稀硫酸滴入碳酸钠溶液中产生的气体通入硅酸钠溶液 | 有白色沉淀生成 | 证明非金属性S>C>Si |
| D | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 | 熔化后的液态铝滴落下来 | 金属铝的熔点较低 |
| A. | A | B. | B | C. | C | D. | D |
| A. | V=1.12 | B. | 原混合酸中c(H2SO4)=0.1mol•L-1 | ||
| C. | 原混合酸中c(H+)=2mol•L-1 | D. | 另一份中消耗铁5.6g |
| A. | 福尔马林(蚁酸):加入足量饱和碳酸钠溶液充分振荡,蒸馏,收集馏出物 | |
| B. | 溴乙烷(乙醇):多次加水振荡,分液,弃水层 | |
| C. | 乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液,弃水层 | |
| D. | 苯(苯酚):加溴水,振荡,过滤除去沉淀 |
 分子中苯环上的一个氢被-C3H7原子团取代形成的有机物共有( )
分子中苯环上的一个氢被-C3H7原子团取代形成的有机物共有( )| A. | 6种 | B. | 8种 | C. | 10种 | D. | 12种 |
| A. | 反应停止了 | B. | 正逆反应速率为零 | ||
| C. | 反应物与生成物的浓度一定相等 | D. | 正逆反应速率相等 |
| A. | 用饱和食盐水和电石在启普发生器中制乙炔 | |
| B. | 用氢氧化钠溶液洗去混在乙酸乙酯中的乙酸 | |
| C. | 把醋酸钠晶体与碱石灰混和,放在试管中加热制甲烷 | |
| D. | 苯和液溴混合于烧瓶中,加入铁粉制溴苯 |

 氯气是氯碱工业的主要产品之一,它是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2OHCl+HClO K=4.5×10-4.次氯酸的强氧化性能杀死水中的病菌(不直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大).但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其他性能优越的消毒产品所替代.请回答:
氯气是氯碱工业的主要产品之一,它是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2OHCl+HClO K=4.5×10-4.次氯酸的强氧化性能杀死水中的病菌(不直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大).但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其他性能优越的消毒产品所替代.请回答: