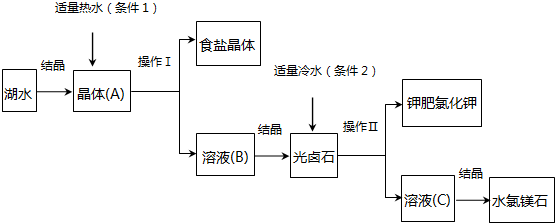
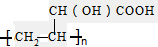题目内容
13.进行下列实验时,仪器和药品选用都正确的是( )| A. | 用饱和食盐水和电石在启普发生器中制乙炔 | |
| B. | 用氢氧化钠溶液洗去混在乙酸乙酯中的乙酸 | |
| C. | 把醋酸钠晶体与碱石灰混和,放在试管中加热制甲烷 | |
| D. | 苯和液溴混合于烧瓶中,加入铁粉制溴苯 |
分析 A.电石和水溶液反应剧烈反应过程中微溶于水的氢氧化钙生成,易堵塞启普发生器;
B.乙酸乙酯和乙酸都能够与氢氧化钠溶液反应;
C.不能用醋酸钠晶体,应该用无水醋酸钠;
D.苯和液溴在铁粉作催化剂条件下可以制取溴苯.
解答 解:A.电石和水溶液反应剧烈反应过程中微溶于水的氢氧化钙生成,堵塞启普发生器,所以不能在启普发生器中进行,故A错误;
B.乙酸乙酯与NaOH溶液反应,不能用氢氧化钠溶液除去乙酸乙酯的乙酸,可以用饱和碳酸钠溶液,故B错误;
C.实验室制甲烷时不能用醋酸钠晶体,而必须用无水醋酸钠,因为有水存在时,CH3COONa和NaOH都是离子化合物发生电离,不能使CH3COONa中C-C和NaOH中O-H键的断裂,因而不能制得甲烷,故C错误;
D.铁和溴单质反应生成溴化铁做催化剂,苯和溴单质发生取代反应,所以将还原铁粉、液溴和苯混合可以制溴苯,故D正确;
故选D.
点评 本题考查了化学实验方案的评价,题目难度不大,涉及常见气体的制备、物质的分离与除杂、溴苯的制取原理等知识,明确常见元素及其化合物性质为解答关键,注意掌握化学实验基本操作方法,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
相关题目
4.下列叙述中正确的是( )
| A. | 元素性质呈现周期性的变化的根本原因是核外电子排布呈周期性变化 | |
| B. | 阴阳离子间通过静电引力而形成的化学键叫做离子键 | |
| C. | 凡是含碳元素的化合物都属于有机化合物 | |
| D. | 甲烷化学性质稳定,点燃前不必验纯 |
1.下列离子方程式或化学反应方程式与所述事实相符且正确的是( )
| A. | 将2molSO3气体通入一密闭容器中,反应达平衡后吸收QkJ热量,则该反应的热化学方程式为:2SO3(g)?2SO2(g)+O2(g)△H=+Q kJ/mol | |
| B. | 向20mL0.5mol•L-1FeBr2溶液中通入224mL Cl2(标准状况):2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| C. | 以金属银为阳极电解饱和硫酸铜溶液 Cu2++2H2O═2Cu+O2↑+4H+ | |
| D. | NH4Al(SO4)2溶液中加入Ba(OH)2溶液至恰好使SO42-完全沉淀::2Ba2++Al3++2SO42-+4OH-═2H2O+2BaSO4↓+AlO2- |
8.下列溶液中溶质的质量百分比浓度最大的是( )
| A. | 福尔马林 | B. | 食醋 | C. | 生理盐水 | D. | 医用酒精 |
2.以下有关物质的量浓度的叙述正确的是( )
| A. | 等体积硫酸铁、硫酸铜、硫酸钾溶液分别与足量的氯化钡溶液反应,若生成的硫酸钡沉淀的质量比为1:2:3,则三种硫酸盐溶液的物质的量浓度比为1:2:3 | |
| B. | 150 mL 1 mol•L-1的氯化钾溶液中的c(Cl-)与50 mL 1 mol•L-1的氯化铝溶液中的c(Cl-)相等 | |
| C. | 20℃时,饱和KCl溶液的密度为1.174 g•cm-3,物质的量浓度为4.0 mol•L-1,则此溶液中KCl的质量分数为$\frac{74.5×4.0}{1.174×1000}$×100% | |
| D. | 20℃时,100 g水可溶解34.2 g KCl,此时KCl饱和溶液的质量分数为34.2% |
3.下列化学用语表示的是离子的有①H2O2②Si ③SO42-④ ⑤$\stackrel{+2}{M}g$( )
⑤$\stackrel{+2}{M}g$( )
 ⑤$\stackrel{+2}{M}g$( )
⑤$\stackrel{+2}{M}g$( )| A. | ①② | B. | ②④ | C. | ③④ | D. | ③⑤ |