题目内容
4.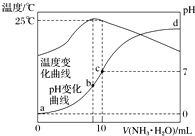 在某温度时,将n mol•L-1氨水滴入10mL 1.0mol•L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示.下列有关说法正确的是( )
在某温度时,将n mol•L-1氨水滴入10mL 1.0mol•L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示.下列有关说法正确的是( )| A. | n=1.0 | |
| B. | 水的电离程度:b>c>a>d | |
| C. | c点:c(NH${\;}_{4}^{+}$)=c(Cl-)=1.0 mol•L-1 | |
| D. | 25℃时,NH4Cl的水解常数(Kh)计算式为=$\frac{(\frac{n}{2}-0.5)×1{0}^{-7}}{0.5}$ |
分析 A、如果n=1,当体积为10ml时两者恰好完全反应生成氯化铵,是强酸弱碱盐水解呈酸性;
B、b点时溶液温度最高,说明氨水与盐酸恰好反应,则b点溶质为氯化铵,铵根离子促进了水的电离,则此时水的电离程度最大;由于d点溶液pH未知,则无法判断a、d两点水的电离程度大小;
C、c点溶液呈中性,所以c(H+)=c(OH-),由电荷守恒分析解答;
D、25℃时溶液的pH=7,则c(H+)=c(OH-)=10-7 mol•L-1,c(NH4+)=c(Cl-)=0.05mol/L,根据物料守恒可知:c(NH3•H2O)=(0.5n-0.05)mol/L,然后结合铵根离子的水解平衡常数表达式计算.
解答 解:A、如果n=1,当体积为10ml时两者恰好完全反应生成氯化铵,是强酸弱碱盐水解呈酸性,所以n>1,故A错误;
B、b点溶液温度最高,说明此时两溶液恰好反应生成氯化铵,铵根离子水解促进了水的电离,则a、d两点都抑制了水的电离,则b点水的电离程度最大;由于d点混合液的pH不知,则无法判断a、d两点水的电离程度大小,故B错误;
C、c点溶液呈中性,所以c(H+)=c(OH-),由电荷守恒分析c(NH4+)+c(H+)=c(Cl-)+c(OH-),所以c(NH4+)=c(Cl-)=0.05mol/L,故C错误;
D.根据图象可知,25℃时溶液的pH=7,则:c(H+)=c(OH-)=10-7 mol•L-1,c(NH4+)=c(Cl-)=0.05mol/L,根据物料守恒可知:c(NH3•H2O)=(0.5n-0.05)mol/L,则25℃时NH4Cl水解常数为:K=$\frac{(0.5n-0.05)×1{0}^{-7}}{0.05}$=$\frac{(\frac{10}{2}n-0.5)×1{0}^{-7}}{0.5}$,故D正确;
故选D.
点评 本题考查了酸碱混合的定性判断及离子浓度大小比较,题目难度中等,涉及水的电离及其影响、酸碱混合的定性判断及溶液pH的计算、离子浓度大小比较、水解平衡常数的计算等知识,D为难点,注意掌握水解平衡常数的表达式及计算方法.

| A. | 核外电子排布完全相同的两种微粒,其化学性质一定相同 | |
| B. | 具有固定熔点或沸点的物质一定是纯净物 | |
| C. | 一种离子和一种分子的质子数和电子数不可能同时相等 | |
| D. | 由分子构成的物质中一定含有共价键 |
| A. | 在蒸馏水中滴加浓硫酸,Kw不变 | |
| B. | 在Na2S稀溶液中,c(H+)=c( OH-)-2c(H2S)-c(HS-) | |
| C. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度不相同 | |
| D. | 将pH=1的强酸溶液加水稀释后,溶液中各离子的浓度均减小 |
| A. | 一定条件下,将1 mol N2和3 mol H2混合发生反应,转移的电子总数为6 NA | |
| B. | 1 L 0.1 mol•L-1的Na2CO3溶液中阴离子的总数大于0.1 NA | |
| C. | 向FeI2溶液中通入适量Cl2,当有2 mol Fe2+被氧化时,消耗Cl2的分子数为NA | |
| D. | 1 mol-CH3中所含的电子总数为10 NA |
 常温下,0.1mol•L-1的HX溶液与0.1mol•L-1的某一元碱ROH溶液加水稀释,两溶液pH与加水体积变化曲线如图,下列说法正确的是( )
常温下,0.1mol•L-1的HX溶液与0.1mol•L-1的某一元碱ROH溶液加水稀释,两溶液pH与加水体积变化曲线如图,下列说法正确的是( )| A. | HX为一种弱酸,ROH为弱碱 | |
| B. | a、b两点由水电离出c(H+)均为10-12mol•L-1 | |
| C. | 两溶液等体积混合 c(X-)=c(R+) | |
| D. | 两溶液等体积混合c(R+)>c(X-)>c(OH-)>c(H+) |
| A. | Na2SiO3可用作助燃剂 | B. | SiO2可用作制造光导纤维 | ||
| C. | 单晶硅可用于制造太阳能电池 | D. | Si可用作制造变压器铁芯的原料 |
| A. | 1 mol•L-1 Na2CO3溶液中,含CO32-数目小于NA | |
| B. | 1molFeCl3完全转化为氢氧化铁胶体后,其中胶体粒子数目为NA | |
| C. | 25℃时,1L pH=12的Ba(OH)2溶液中含有的OH-数目为0.02 NA | |
| D. | 1 mol苯和苯甲酸的混合物完全燃烧时消耗O2的分子数为7.5NA |