题目内容
19.设NA为阿伏加德罗常数的值.下列说法正确的是( )| A. | 一定条件下,将1 mol N2和3 mol H2混合发生反应,转移的电子总数为6 NA | |
| B. | 1 L 0.1 mol•L-1的Na2CO3溶液中阴离子的总数大于0.1 NA | |
| C. | 向FeI2溶液中通入适量Cl2,当有2 mol Fe2+被氧化时,消耗Cl2的分子数为NA | |
| D. | 1 mol-CH3中所含的电子总数为10 NA |
分析 A.合成氨为可逆反应;
B.碳酸根离子为弱酸根离子,水溶液中部分水解;
C.碘离子还原性强于二价铁子,氯气先氧化碘离子再氧化二价铁离子;
D.1个甲基含有9个电子;
解答 解:A.一定条件下,将1 mol N2和3 mol H2混合发生反应生成氨气小于2mol,转移的电子总数小于6 NA,故A错误;
B.1 L 0.1 mol•L-1的Na2CO3溶液中阴离子的总数大于0.1 NA,故B正确;
C.向FeI2溶液中通入适量Cl2,当有2 mol Fe2+被氧化时,消耗Cl2的分子数大于NA,故C错误;
D.1 mol-CH3中所含的电子总数为9NA,故D错误;
故选:B.
点评 本题考查阿伏加德罗常数的有关计算和判断,注意明确标况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系是解题关键,注意碘离子与二价铁离子还原性强弱关系,题目难度中等.

练习册系列答案
相关题目
15. Q、R、T、X、Y、Z是六种原子序数依次增大的前四周期常见元素,其相关信息如表:
Q、R、T、X、Y、Z是六种原子序数依次增大的前四周期常见元素,其相关信息如表:
(1)Z元素的原子基态时的电子排布式是1s22s22p63s23p63d104s1
(2)下列叙述正确的是d
a.Q的最简单气态氢化物比R的气体氢化物稳定
b.Q的含氧酸一定比R的含氧酸酸性强
c.R的气态氢化物的熔点在同族元素形成的氢化物中最低
d.R的第一电离能、电负性都比Q大
(3)Q和T可形成两种常见化合物,分别表示为QT与QT2.QT分子中σ键π键的个数比为1:2;QT2分子中,Q原子采取sp杂化.
(4)笑气(R2T)是一种麻醉剂,有关理论认为R2T与QT2具有相似的结构.故的空间构型为直线形,且为非极性(填“极性”或“非极性”)分子.
(5)现有Q、Y和镁三种元素的某种晶体具有超导性,其晶胞结构如图所示.该晶体的化学式为MgNi3C;晶体中每个镁原子周围距离相等且最近的Y原子有12个.
 Q、R、T、X、Y、Z是六种原子序数依次增大的前四周期常见元素,其相关信息如表:
Q、R、T、X、Y、Z是六种原子序数依次增大的前四周期常见元素,其相关信息如表:| 元素 | 相关信息 |
| Q | Q的单质是实验室常用的惰性电极材料 |
| R | R原子基态时2p原子轨道上有3个未成对电子 |
| T | 负二价的元素T的氢化物在通常情况下是一种液体,且 T的质量分数为88.9% |
| X | X是第三周期电负性最大的元素 |
| Y | 元素Y位于周期表第10列 |
| Z | Z存在质量数为65,中子数为36的核素 |
(2)下列叙述正确的是d
a.Q的最简单气态氢化物比R的气体氢化物稳定
b.Q的含氧酸一定比R的含氧酸酸性强
c.R的气态氢化物的熔点在同族元素形成的氢化物中最低
d.R的第一电离能、电负性都比Q大
(3)Q和T可形成两种常见化合物,分别表示为QT与QT2.QT分子中σ键π键的个数比为1:2;QT2分子中,Q原子采取sp杂化.
(4)笑气(R2T)是一种麻醉剂,有关理论认为R2T与QT2具有相似的结构.故的空间构型为直线形,且为非极性(填“极性”或“非极性”)分子.
(5)现有Q、Y和镁三种元素的某种晶体具有超导性,其晶胞结构如图所示.该晶体的化学式为MgNi3C;晶体中每个镁原子周围距离相等且最近的Y原子有12个.
7.下列说法正确的是( )
| A. | 油脂、纤维素、淀粉都是高分子化合物 | |
| B. | 煤的干馏、蛋白质的变性和纳米银粒子的聚焦都是化学变化 | |
| C. | 酒精、甲苯、四氯化碳都能萃取碘水中的碘单质 | |
| D. | 乙烯、乙炔都可作为合成聚合物的单体 |
14.短周期元素W、X、Y、Z在元素周期表中的位置如图所示.其中Z的单质是一种重要半导体材料.广泛应用于电子工业的各个领域.
(1)W在元素周期表中的位置是第二周期第ⅣA族;
(2)W、X、氢元素形成的三原子分子的电子式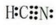 ;
;
(3)下列选项中,能证明元素非金属性X强于W的是CD;
A.原子序数:X>W
B.最低化合价:X>W
C.最简单氢化物的稳定性:X>W
D.最高价氧化物的水化物酸性:X>W
(4)元素周期表中与Z同周期的某金属元素形成的单质A,可发生如图所示的转化:
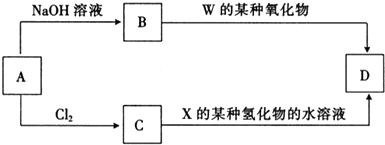
其中化合物D是一种白色沉淀,则B中溶质的化学式为NaAlO2;B与C也可直接转化生成D,写出对应的离子方程式为Al3++6H2O+3AlO2-=4Al(OH)3↓.
| W | X | ||
| Y | Z |
(2)W、X、氢元素形成的三原子分子的电子式
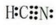 ;
;(3)下列选项中,能证明元素非金属性X强于W的是CD;
A.原子序数:X>W
B.最低化合价:X>W
C.最简单氢化物的稳定性:X>W
D.最高价氧化物的水化物酸性:X>W
(4)元素周期表中与Z同周期的某金属元素形成的单质A,可发生如图所示的转化:

其中化合物D是一种白色沉淀,则B中溶质的化学式为NaAlO2;B与C也可直接转化生成D,写出对应的离子方程式为Al3++6H2O+3AlO2-=4Al(OH)3↓.
4.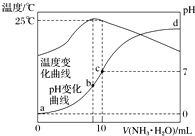 在某温度时,将n mol•L-1氨水滴入10mL 1.0mol•L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示.下列有关说法正确的是( )
在某温度时,将n mol•L-1氨水滴入10mL 1.0mol•L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示.下列有关说法正确的是( )
 在某温度时,将n mol•L-1氨水滴入10mL 1.0mol•L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示.下列有关说法正确的是( )
在某温度时,将n mol•L-1氨水滴入10mL 1.0mol•L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示.下列有关说法正确的是( )| A. | n=1.0 | |
| B. | 水的电离程度:b>c>a>d | |
| C. | c点:c(NH${\;}_{4}^{+}$)=c(Cl-)=1.0 mol•L-1 | |
| D. | 25℃时,NH4Cl的水解常数(Kh)计算式为=$\frac{(\frac{n}{2}-0.5)×1{0}^{-7}}{0.5}$ |
11. 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
(1)卤族元素位于周期表的p区;溴的价电子排布式为4s24p5.
(2)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是碘.
(3)已知高碘酸有两种形式,分别为H5IO6(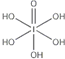 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)
(4)与KI3类似的,还有CsICl2等.已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列A式发生.
A.CsICl2=CsCl+ICl
B.CsICl2=CsI+Cl2
(5)已知ClO2-为角型,中心氯原子周围有四对价层电子.ClO2-中心氯原子的杂化轨道类型为sp3,与ClO2-互为等电子体的微粒是Cl2O.(任写一个)
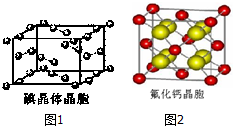
(6)图1为碘晶体晶胞结构.有关说法中正确的是AD.
A.碘分子的排列有2种不同的取向,2种取向不同
的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中的碘原子间存在非极性键和范德华力
(7)已知CaF2晶体(见图2)的密度为ρg/cm3,NA为阿伏加德罗常数,相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为$\frac{\sqrt{2}}{2}$ρNAa3.
 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.(1)卤族元素位于周期表的p区;溴的价电子排布式为4s24p5.
(2)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是碘.
| 氟 | 氯 | 溴 | 碘 | 铍 | |
| 第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)(4)与KI3类似的,还有CsICl2等.已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列A式发生.
A.CsICl2=CsCl+ICl
B.CsICl2=CsI+Cl2
(5)已知ClO2-为角型,中心氯原子周围有四对价层电子.ClO2-中心氯原子的杂化轨道类型为sp3,与ClO2-互为等电子体的微粒是Cl2O.(任写一个)
(6)图1为碘晶体晶胞结构.有关说法中正确的是AD.
A.碘分子的排列有2种不同的取向,2种取向不同
的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中的碘原子间存在非极性键和范德华力
(7)已知CaF2晶体(见图2)的密度为ρg/cm3,NA为阿伏加德罗常数,相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为$\frac{\sqrt{2}}{2}$ρNAa3.
8.下列有关物理量与其单位匹配正确的是( )
| A. | 质量--g | B. | 反应速率--mol•L-1 | ||
| C. | 摩尔质量--g•mol-1 | D. | 气体摩尔体积--L•mol-1 |
9.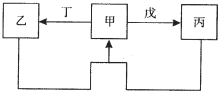 甲、乙、丙、丁、戊五种物质中,甲、乙、丙中均含有某种相同的元素,它们之间具有如图所示转化关系(反应条件及部分产物已略去).下列有关物质的推断不正确的是( )
甲、乙、丙、丁、戊五种物质中,甲、乙、丙中均含有某种相同的元素,它们之间具有如图所示转化关系(反应条件及部分产物已略去).下列有关物质的推断不正确的是( )
 甲、乙、丙、丁、戊五种物质中,甲、乙、丙中均含有某种相同的元素,它们之间具有如图所示转化关系(反应条件及部分产物已略去).下列有关物质的推断不正确的是( )
甲、乙、丙、丁、戊五种物质中,甲、乙、丙中均含有某种相同的元素,它们之间具有如图所示转化关系(反应条件及部分产物已略去).下列有关物质的推断不正确的是( )| 选项 | 假设 | 结论 |
| A | 甲为Al(OH)3 | 丁可能是盐酸 |
| B | 甲为Na2CO3溶液 | 戊可能是CO2 |
| C | 甲为Fe | 丁可能是盐酸 |
| D | 甲为N2 | 戊可能是氧气 |
| A. | A | B. | B | C. | C | D. | D |