题目内容
15.下列说法中正确的是( )| A. | 核外电子排布完全相同的两种微粒,其化学性质一定相同 | |
| B. | 具有固定熔点或沸点的物质一定是纯净物 | |
| C. | 一种离子和一种分子的质子数和电子数不可能同时相等 | |
| D. | 由分子构成的物质中一定含有共价键 |
分析 A、核外电子排布完全相同的两种微粒不一定属于同种元素,化学性质不一定相同;
B、混合物没有固定熔点,纯净物有固定熔点;
C、离子带电荷,质子数一定不等于电子数;分子不带电,质子数等于电子数;
D、由分子是单原子分子,则组成的物质中不一定含有共价键;
解答 解:A、核外电子排布完全相同的两种微粒不一定属于同种元素,化学性质不一定相同,如K+与Cl-核外电子排布相同,但是二者化学性质不同,故A错误;
B、只有纯净物有固定熔沸点,故B正确;
C、离子带电荷,质子数一定不等于电子数;分子不带电,质子数等于电子数,当离子和分子的质子数相同时,他们的电子数一定不相同,故C正确;
D、由分子组成的物质中不一定含有共价键,如稀有气体,故D错误;
故选:BC.
点评 本题为综合题,考查了原子结构、物质的熔沸点、电解质的电离,综合性强,题目难度不大,侧重考查学生对基础知识的掌握.

练习册系列答案
相关题目
11.重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放.
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强.为回收利用,通常采用如下流程处理:
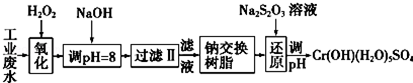
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表.
(1)氧化过程中可代替H2O2加入的试剂是A(填序号).
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是AB;(填下列选项)已知钠离子交换树脂的原理:Mn++nNaR-→MRn+nNa+,此步操作被交换除去的杂质离子是CD.(填下列选项)
A.Fe3+ B. Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,每消耗0.8mol Cr2O72-转移4.8mol e-,该反应离子方程式为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O.
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水:
该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液.
(1)电解时能否用Cu电极来代替Fe电极?不能(填“能”或“不能”),理由是因阳极产生的Cu2+不能使Cr2O72-还原到低价态.
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O.
(3)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为5时才能使c(Cr3+)降至10-5 mol•L-1.
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强.为回收利用,通常采用如下流程处理:

注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表.
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是AB;(填下列选项)已知钠离子交换树脂的原理:Mn++nNaR-→MRn+nNa+,此步操作被交换除去的杂质离子是CD.(填下列选项)
A.Fe3+ B. Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,每消耗0.8mol Cr2O72-转移4.8mol e-,该反应离子方程式为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O.
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水:
该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液.
(1)电解时能否用Cu电极来代替Fe电极?不能(填“能”或“不能”),理由是因阳极产生的Cu2+不能使Cr2O72-还原到低价态.
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O.
(3)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为5时才能使c(Cr3+)降至10-5 mol•L-1.
12.分类方法在化学科学的发展中起到了非常重要的作用,下列分类标准合理的是( )
| A. | 根据酸分子中含有氢原子的个数,将酸分为一元酸、二元酸等 | |
| B. | 根据化合物在溶液中电离出的离子的类别,将化合物分为酸、碱、盐 | |
| C. | 根据化学反应中有无单质参加或生成,将化学反应分为氧化还原反应和非氧化还原反应 | |
| D. | 四种基本反应类型未能包括所有的化学反应,酸性氧化物、碱性氧化物、两性氧化物的分类包括了所有的氧化物 |
20.短周期元素A、B、C、D的原子序数依次增大.它们的原子序数之和为36,且原子的最外层电子数之和为14; A、C原子的最外层电子数之和等于B原子的次外层电子数;A与C,B与D分别为同主族元素.下列叙述正确的是( )
| A. | 在地壳中,B元素的含量位于第二位 | |
| B. | C元素的单质熔点低,在空气中加热时先熔化后燃烧 | |
| C. | A、B、D三种元素形成的化合物一定是强酸 | |
| D. | B元素与A元素形成的物质一定是纯净物 |
7.下列说法正确的是( )
| A. | 油脂、纤维素、淀粉都是高分子化合物 | |
| B. | 煤的干馏、蛋白质的变性和纳米银粒子的聚焦都是化学变化 | |
| C. | 酒精、甲苯、四氯化碳都能萃取碘水中的碘单质 | |
| D. | 乙烯、乙炔都可作为合成聚合物的单体 |
4.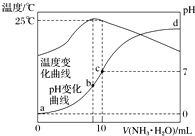 在某温度时,将n mol•L-1氨水滴入10mL 1.0mol•L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示.下列有关说法正确的是( )
在某温度时,将n mol•L-1氨水滴入10mL 1.0mol•L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示.下列有关说法正确的是( )
 在某温度时,将n mol•L-1氨水滴入10mL 1.0mol•L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示.下列有关说法正确的是( )
在某温度时,将n mol•L-1氨水滴入10mL 1.0mol•L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示.下列有关说法正确的是( )| A. | n=1.0 | |
| B. | 水的电离程度:b>c>a>d | |
| C. | c点:c(NH${\;}_{4}^{+}$)=c(Cl-)=1.0 mol•L-1 | |
| D. | 25℃时,NH4Cl的水解常数(Kh)计算式为=$\frac{(\frac{n}{2}-0.5)×1{0}^{-7}}{0.5}$ |
 和C3H8O3(甘油)以一定比例混合,测定混合物中含碳51.3%,那么氢元素的质量分数是8.7%(取2位有效数字,下同);氧元素的质量分数是40%.
和C3H8O3(甘油)以一定比例混合,测定混合物中含碳51.3%,那么氢元素的质量分数是8.7%(取2位有效数字,下同);氧元素的质量分数是40%.