题目内容
8.下列各组均为两种化合物溶于水时电离出的离子,其中按照仅由酸、碱、盐依次电离的是( )①Na+、OH-、SO42-
②H+、Cl-、SO42-
③Na+、K+、OH-
④Na+、K+、NO3-.
| A. | ②③④ | B. | ②①④ | C. | ②③① | D. | ②①③ |
分析 酸的概念是根据物质溶于水解离成的阳离子全部为H+来确定的,则在酸的溶液中不会存在金属阳离子,碱是指在电离时产生的阴离子全部是氢氧根离子的化合物;
盐是由金属离子和酸根离子组成的化合物.
解答 解:①Na+不可能是酸电离产生的,酸电离产生的阳离子应全部为H+,为碱、或盐电离,为氢氧化钠或硫酸钠电离;
②因阳离子全部为H+,可理解为盐酸和硫酸两种物质溶于水时电离出的离子;
③Na+、K+不可能是酸电离产生的,因阴离子只有OH-,应为两种碱;
④Na+、K+、NO3-溶液中无H+,不会是酸电离产生的,因有金属离子和硝酸根离子,则为盐电离产生的离子;
按照仅由酸、碱、盐依次电离的是②③④,
故选A.
点评 本题考查了概念的理解和判断,能够从离子的角度来认识酸、碱、盐的概念和构成,并熟悉常见的酸、碱、盐,题目难度不大.

练习册系列答案
相关题目
18.下列物质的溶液经加热、蒸发、浓缩、结晶、灼烧后,所得固体的成分不相同的是( )
| A. | FeCl2、FeCl3 | B. | NaHCO3、Na2CO3 | C. | NaAlO2、AlCl3 | D. | Mg(HCO3)2、MgCl2 |
19.乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:
2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g)△H=-256.1kJ•mol-1
已知:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ•mol-1
(1)以CO2(g)与H2(g)为原料也可合成乙醇,其热化学方程式如下:
2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H=-173.7kJ•mol-1.
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题.
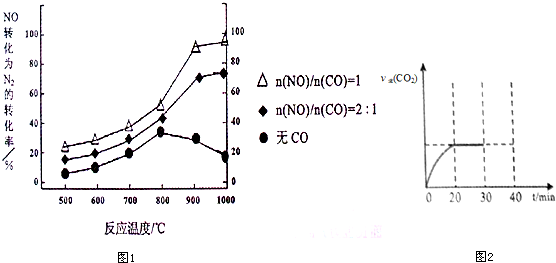
①某研究小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率随温度变化情况如图1.若不使用CO,温度超过800℃,发现NO的转化率降低,其可能的原因为该反应是放热反应,升高温度反应更有利于向逆反应方向进行;在n(NO)/n(C O)=1的条件下,应控制的最佳温度在900℃左右.
②用活性炭还原法处理氮氧化物.有关反应为:C (s)+2NO2(g)?N2 (g)+CO2 (g).某研究小组向某密闭容器中加人足量的活性炭和NO,恒温( T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
I.根据表中数据,求反应开始至20min以v(NO)表示的反应速率为0.030mol•L-1•mol-1(保留两位有效数字),T1℃时该反应的平衡常数为0.56(保留两位有效数字).
II.30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是减小CO2的浓度.图2表示CO2的逆反应速率[v逆(CO2)]随反应时间的变化关系图.请在图中画出在30min改变上述条件时,在40min时刻再次达到平衡的变化曲线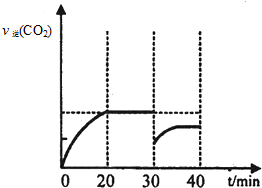 .
.
2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g)△H=-256.1kJ•mol-1
已知:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ•mol-1
(1)以CO2(g)与H2(g)为原料也可合成乙醇,其热化学方程式如下:
2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H=-173.7kJ•mol-1.
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题.
①某研究小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率随温度变化情况如图1.若不使用CO,温度超过800℃,发现NO的转化率降低,其可能的原因为该反应是放热反应,升高温度反应更有利于向逆反应方向进行;在n(NO)/n(C O)=1的条件下,应控制的最佳温度在900℃左右.

②用活性炭还原法处理氮氧化物.有关反应为:C (s)+2NO2(g)?N2 (g)+CO2 (g).某研究小组向某密闭容器中加人足量的活性炭和NO,恒温( T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
| 浓度/mol?L-1 时间/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
II.30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是减小CO2的浓度.图2表示CO2的逆反应速率[v逆(CO2)]随反应时间的变化关系图.请在图中画出在30min改变上述条件时,在40min时刻再次达到平衡的变化曲线
 .
.
16.为了测定铁铜合金的组成,将7.6g铁、铜合金加入100mL某浓度的稀硝酸中,待合金完全溶解后,共收集到NO气体2.24L(标准状况下),并测得溶液中H+的浓度为0.5mol•L-1.若反应前后溶液的体积变化忽略不计,则下列判断正确的是( )
| A. | 上述反应中金属共失去电子0.1 mol | |
| B. | 合金中,铜的质量为2.8 g | |
| C. | 原硝酸的浓度:c(HNO3)=4.5 mol•L-1 | |
| D. | 要使溶液中的金属离子完全沉淀,需加5 mol•L-1的NaOH溶液60 mL |
13.在含有较多NH4+、Ba2+、H+、Cl-的溶液中还能大量共存的离子是( )
| A. | SO42ˉ | B. | Mg2+ | C. | CH3COO- | D. | OHˉ |
20.称取铁粉和氧化铜的混合物6.40g,进行如下实验:
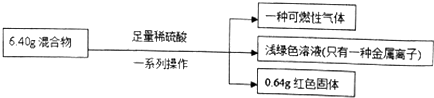
根据实验所得数据,下列说法不正确的是( )

根据实验所得数据,下列说法不正确的是( )
| A. | 原混合物中铜元素的质量一定为0.64g | |
| B. | 生成气体体积为2.016L | |
| C. | 实验中反应的硫酸的物质的量为0.1mol | |
| D. | 原混合物中铁的质量分数为87.5% |
17.下列有机物命名正确的是( )
| A. |  2-乙基丙烷 2-乙基丙烷 | B. | CH3CH2CH2OH 1-丁醇 | ||
| C. |  对二甲苯 对二甲苯 | D. |  2-甲基-2-丙烯 2-甲基-2-丙烯 |
