题目内容
11.“神七”登天谱写了我国航天事业的新篇章.火箭升空需要高能的燃料,通常用肼(N2H4)作为燃料,N2O4做氧化剂.(1)已知:N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ•mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ•mol-1
2NO2(g)?N2O4(g)△H=-52.7kJ•mol-1
试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1083.0kJ•mol-1.
(2)工业上可用次氯酸钠与过量的氨反应制备肼,该反应的化学方程式为:NaClO+2NH3=N2H4+NaCl+H2O.
(3)一定条件下,在2L密闭容器中起始投入2mol NH3和4mol O2发生反应:
4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0
测得平衡时数据如下:
| 平衡时物质的量(mol) | n(NO) | n(H2O) |
| 温度T1 | 1.6 | 2.4 |
| 温度T2 | 1.2 | 1.8 |
②温度T1和T2的大小关系是T1<T2(填“>”、“<”或“=”).
(4)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2.某种电化学装置可实现如下转化:2CO2═2CO+O2,CO可用作燃料.已知该反应的阳极反应为:4OH--4e-═O2↑+2H2O,则阴极反应为2CO2+4e-+2H2O=2CO+4OH-.有人提出,可以设计反应2CO═2C+O2(△H>0)来消除CO的污染.请你判断上述反应是否能自发进行并说明理由不能,因为该反应的△H>0,△S<O.
(5)图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解液.
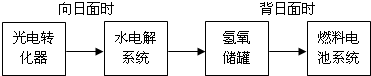
如果某段时间内氢氧储罐中共收集到33.6L气体(已折算成标准状况),则该段时间内水电解系统中转移电子的物质的量为2mol.
分析 (1)依据热化学方程式和盖斯定律计算得到,
由盖斯定律:①N2(g)+2O2(g)=2NO2(g)△H1=+67.7kJ•mol-1
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H2=-534.0kJ•mol-1
③2NO2(g)N2O4(g)△H3=-52.7kJ•mol-1
②×2-①-③得到;
(2)次氯酸钠与过量的氨反应制备肼,依据反应物和生成物,结合原子守恒写出化学方程式;
(3)①分析图表数据结合化学反应速率概念计算得到;
②反应在T2时生成物的平衡浓度减小,说明平衡逆向进行,反应是放热反应,逆向是吸热反应,依据平衡移动原理判断,T1<T2;
(4)2CO2═2CO+O2,CO可用作燃料.已知该装置的阳极反应为:4OH--4e-═O2↑+2H2O,阴极反应依据电子守恒总反应减去阳极反应得到;依据自发进行的判断依据△H-T△S<0分析判断;
(5)依据电解水的化学方程式,依据电子守恒结合电极产物分析计算;
解答 解:(1)①N2(g)+2O2(g)═2NO2(g)△H=+67.7kJ•mol-1
②N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.0kJ•mol-1
③2NO2(g)═N2O4(g)△H=-52.7kJ•mol-1
依据盖斯定律②-(①+③)得到2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1 083.0 kJ•mol-1;
故答案为:2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1083.0 kJ•mol-1;
(2)次氯酸钠与过量的氨反应制备肼氨气被氧化为肼,本身被还原为氯离子,结合原子守恒配平写出化学方程式为:NaClO+2NH3═N2H4+NaCl+H2O;
故答案为:NaClO+2NH3═N2H4+NaCl+H2O;
(3)①
4NH3(g)+5O2(g)?4NO(g)+6H2O(g)
起始量(mol) 2 4 0 0
变化量(mol) 1.6 2 1.6 2.4
平衡量(mol) 0.4 2 1.6 2.4
在T1时,若经过10min反应达到平衡,则10min内反应的平均速率v(NH3)=$\frac{\frac{1.6mol}{2L}}{10min}$=0.08mol•L-1•min-1;
故答案:0.08 mol•L-1•min-1;
②反应在T2时生成物的平衡浓度减小,说明平衡逆向进行,反应是放热反应,逆向是吸热反应,依据平衡移动原理判断,T1<T2;
故答案为:<;
(4)2CO2═2CO+O2,CO可用作燃料.已知该装置的阳极反应为:4OH--4e-═O2↑+2H2O,阴极反应依据电子守恒总反应减去阳极反应得到:2CO2+4e-+2H2O═2CO+4OH-(或CO2+2e-+H2O═CO+2OH-);2CO═2C+O2 △H>0△S<0,△H-T△S>0,反应一定不能自发进行;
故答案为:2CO2+4e-+2H2O═2CO+4OH-(或CO2+2e-+H2O═CO+2OH-);不能,因为该反应的△S<0;
(5)氢氧储罐中共收集到33.6L气体(已折算成标准状况)物质的量=$\frac{33.6L}{22.4L/mol}$=1.5mol,发生的反应为2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,氢气物质的量=$\frac{2}{3}$×1.5mol=1mol,氧气物质的量为0.5mol,则该段时间内水电解系统中转移电子的物质的量为2mol;
故答案为:2;
点评 本题考查热化学方程式和盖斯定律计算应用,化学平衡的影响因素分析判断,反应速率的计算应用,原电池电极反应书写方法,电解过程中电子转移的计算应用,题目难度中等.

①钠的化合物②能与硝酸反应的物质 ③可溶于水的物质 ④水溶液导电 ⑤钠盐 ⑥钠的含氧化合物.
| A. | ①④⑤ | B. | ①②⑤⑥ | C. | ①③④ | D. | ②⑤⑥ |
2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g)△H=-256.1kJ•mol-1
已知:CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ•mol-1
(1)以CO2(g)与H2(g)为原料也可合成乙醇,其热化学方程式如下:
2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H=-173.7kJ•mol-1.
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题.
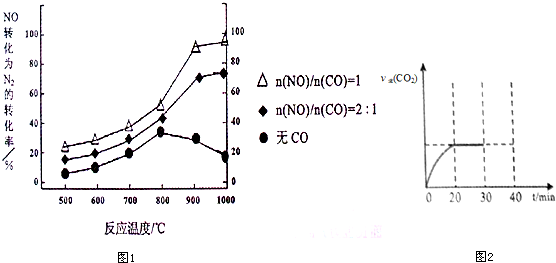
①某研究小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率随温度变化情况如图1.若不使用CO,温度超过800℃,发现NO的转化率降低,其可能的原因为该反应是放热反应,升高温度反应更有利于向逆反应方向进行;在n(NO)/n(C O)=1的条件下,应控制的最佳温度在900℃左右.
②用活性炭还原法处理氮氧化物.有关反应为:C (s)+2NO2(g)?N2 (g)+CO2 (g).某研究小组向某密闭容器中加人足量的活性炭和NO,恒温( T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
| 浓度/mol?L-1 时间/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
II.30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是减小CO2的浓度.图2表示CO2的逆反应速率[v逆(CO2)]随反应时间的变化关系图.请在图中画出在30min改变上述条件时,在40min时刻再次达到平衡的变化曲线
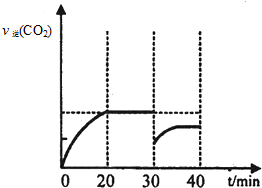 .
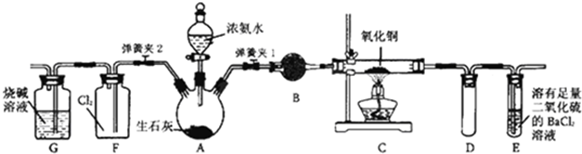
. 图中:
①为氯气发生装置;
②的试管里盛有15mL30%NaOH溶液来制取氯酸钠,并置于热水浴中;
③的试管里盛有15mL8%NaOH溶液来制取次氯酸钠,并置于冰水浴中;
④的试管里加有紫色石蕊试液;
⑤为尾气吸收装置.
请填写下列空白:
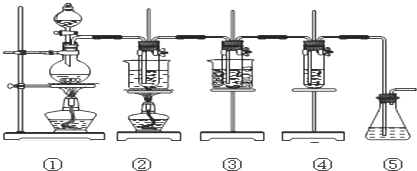
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过分液漏斗(仪器名称)向烧瓶中加入适量的浓盐酸.实验室制Cl2的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
实验时为了除去氯气中的HCl气体,可在①与②之间安装盛有C(填写下列编号字母)的净化装置.
A.碱石灰 B.氢氧化钠溶液 C.饱和食盐水 D.浓硫酸
(2)如果将过量二氧化锰与20mL12mol•L-1的浓盐酸混合加热,充分反应后生成的氯气小于0.06mol.(填“大于”“小于”或“等于”),若有17.4g的MnO2被还原,则被氧化的HCl的物质的量为0.4mol.
(3)写出装置②中发生反应的化学方程式3Cl2+6NaOH$\frac{\underline{\;\;△\;\;}}{\;}$5NaCl+NaClO3+3H2O.
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白.
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为红色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | HClO有强氧化性,体现漂白作用是其褪色 |
| 然后溶液从无色逐渐变为浅绿色 | 溶液中溶解了大量的氯气,体现浅绿色 |
| A. | 上述反应中金属共失去电子0.1 mol | |
| B. | 合金中,铜的质量为2.8 g | |
| C. | 原硝酸的浓度:c(HNO3)=4.5 mol•L-1 | |
| D. | 要使溶液中的金属离子完全沉淀,需加5 mol•L-1的NaOH溶液60 mL |
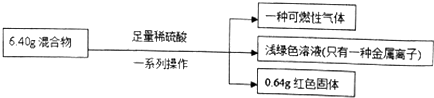
根据实验所得数据,下列说法不正确的是( )
| A. | 原混合物中铜元素的质量一定为0.64g | |
| B. | 生成气体体积为2.016L | |
| C. | 实验中反应的硫酸的物质的量为0.1mol | |
| D. | 原混合物中铁的质量分数为87.5% |