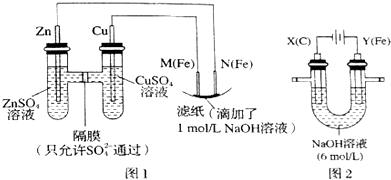
题目内容
12.下列电离或水解方程式书写正确的是( )| A. | NaHCO3═CO32-+H++Na+ | B. | S2-+H2O?H2S+2 OH- | ||
| C. | H3PO4?3H++PO43- | D. | NH3•H2O?NH4++OH- |
分析 A.碳酸氢根离子为弱酸的酸式根离子,应保留化学式;
B.硫离子为多元弱酸的酸式根离子,分步水解,以第一步为主;
C.磷酸为弱电解质,分步电离;
D.一水合氨为弱电解质,部分电离.
解答 解:A.碳酸氢钠为强电解质,完全电离,电离方程式:NaHCO3═HCO3-+Na+,故A错误;
B.硫离子为多元弱酸的酸式根离子,分步水解,以第一步为主,水解离子方程式:S2-+H2O?HS-+OH-,故B错误;
C.磷酸为弱电解质,分步电离,以第一步为主:H3PO4?H++H2PO4-,故C错误;
D.一水合氨为弱电解质,部分电离,电离方程式:NH3•H2O?NH4++OH-,故D正确;
故选:D.
点评 本题考查了电解质电离方程式、盐类水解的离子方程式,熟悉电解质强弱及电离方式、明确盐类水解规律是解题关键,题目难度不大.

练习册系列答案
相关题目
2.Na2O、NaOH、Na2CO3、NaCl、Na2SO4可按某种标准划为同一类物质,下列分类标准正确的是( )(已知Na2O与水反应生成NaOH)
①钠的化合物②能与硝酸反应的物质 ③可溶于水的物质 ④水溶液导电 ⑤钠盐 ⑥钠的含氧化合物.
①钠的化合物②能与硝酸反应的物质 ③可溶于水的物质 ④水溶液导电 ⑤钠盐 ⑥钠的含氧化合物.
| A. | ①④⑤ | B. | ①②⑤⑥ | C. | ①③④ | D. | ②⑤⑥ |
20.称取铁粉和氧化铜的混合物6.40g,进行如下实验:
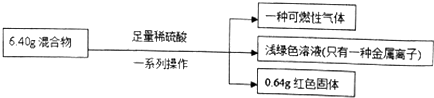
根据实验所得数据,下列说法不正确的是( )

根据实验所得数据,下列说法不正确的是( )
| A. | 原混合物中铜元素的质量一定为0.64g | |
| B. | 生成气体体积为2.016L | |
| C. | 实验中反应的硫酸的物质的量为0.1mol | |
| D. | 原混合物中铁的质量分数为87.5% |
17.下列有机物命名正确的是( )
| A. |  2-乙基丙烷 2-乙基丙烷 | B. | CH3CH2CH2OH 1-丁醇 | ||
| C. |  对二甲苯 对二甲苯 | D. |  2-甲基-2-丙烯 2-甲基-2-丙烯 |
4.铁及其化合物在国民经济、日常生活中占有非常重要的地位,了解铁及其化合物的性质和用途非常重要.请回答下列问题:
(1)铁在自然界中以化合态存在,其氧化物呈黑色的是FeO、Fe3O4,呈红棕色的是Fe2O3(填写化学式).
(2)铁在纯氧气中燃烧的化学方程式为3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4.
红热的铁片投入水中,表面生成一层黑色晶体,反应的化学方程式为3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
(3)铁合金有下列数据:
取25g某碳素钢样品,按下列实验流程进行操作:
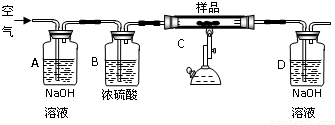
①A、B的作用是除去空气中的二氧化碳和水蒸气,
②充分加热完全反应后,D装置质量增加0.33g,该样品属于中碳钢.
③没有A、B装置,实验结果偏高(填“偏高”“偏低”“不影响”)
(1)铁在自然界中以化合态存在,其氧化物呈黑色的是FeO、Fe3O4,呈红棕色的是Fe2O3(填写化学式).
(2)铁在纯氧气中燃烧的化学方程式为3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4.
红热的铁片投入水中,表面生成一层黑色晶体,反应的化学方程式为3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
(3)铁合金有下列数据:
| 钢 | |||
| 碳素钢(Fe、C、Mn、Si) | 合金钢 | ||
| 低碳钢 | 中碳钢 | 高碳钢 | 碳素钢+Cr、Mn、W、Ni、Co等 |
| 含碳量<0.3% | 含碳量0.3%~0.6% | 含碳量>0.6% | |
| 韧性好,强度低 | 韧性好、强度好 | 硬而脆 | 具有特殊性能 |

①A、B的作用是除去空气中的二氧化碳和水蒸气,
②充分加热完全反应后,D装置质量增加0.33g,该样品属于中碳钢.
③没有A、B装置,实验结果偏高(填“偏高”“偏低”“不影响”)
2.下列叙述正确的是( )
| A. | 1 mol任何物质都含有6.02×1023个原子 | |
| B. | 标准状况下,22.4L NH3的物质的量为1mol | |
| C. | 硫酸的摩尔质量是98 g | |
| D. | 常温常压下,1 mol氧气的体积为22.4 L |