题目内容
6. 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表:
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表:| 实验编号 | HA物质的量浓度 (mol•L-1) | NaOH物质的量浓度 (mol•L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
(1)从第①组情况分析,混合溶液pH=9的原因是A-+H2O?HA+OH-(用离子方程式表示),该组所得混合溶液中由水电离出的c(OH-)=10-5mol•L-1.
(2)第②组情况表明,c>0.2(选填“>”、“<”或“=”),该混合液中离子浓度c(A-) 与c(Na+) 的大小关系是c(A-)=c(Na+).
(3)从第③组实验结果分析,说明此时HA的电离程度>NaA的水解程度(选填“>”、“<”或“=”),该混合溶液中各离子浓度由大到小的顺序是c(A-)>c(Na+)>c(H+)>c(OH-).
(4)将一定浓度的NaA溶液稀释100倍时,其pH变化如图 A、B、C曲线中的B(填字母)曲线.
(5)由上述所涉及的溶质组成以下四组等体积溶液:
甲:0.1mol/LNaA
乙:0.1mol/LNaA和0.1mol/LHA
丙:0.1mol/LHA
丁:0.1mol/LNaA和0.1mol/LNaOH
则A-离子浓度由大到小的顺序为乙>丁>甲>丙(填序号).
分析 (1)①中等体积等浓度混合,恰好生成正盐,pH=9,则生成强碱弱酸盐;溶液中的氢氧根离子是水电离的,根据常温下水的离子积计算出由水电离出的c(OH-);(2)若酸为强酸,等体积等浓度混合时pH=7;而HA为弱酸,等体积等浓度混合溶液的pH大于7,则为保证pH=7,应使酸浓度大于0.2mol/L;b中溶液pH=7,说明c(H+)=c(OH-),结合电荷守恒分析离子浓度关系;
(3)第③组混合溶液中溶质为HA、NaA,该溶液显酸性,说明HA的电离程度大于NaA的水解程度;溶液中c(A-)>c(Na+);
(4)加水稀释溶液的碱性减弱,pH减小,稀释100倍,pH变化小于2个单位;
(5)盐为强电解质,完全电离,HA为弱电解质,部分电离,强碱弱酸盐易水解,但较微弱.
解答 解:(1)①中等体积等浓度混合,恰好生成正盐,pH=9,则生成强碱弱酸盐,说明HA为弱酸,A-在溶液中水解显碱性,其水解方程式为:A-+H2O?HA+OH-;由a组实验所得混合溶液为NaA溶液,溶液pH=9,说明NaA为强碱弱酸盐,溶液中的氢氧根离子是水电离的,所以水电离的溶液中的c(OH-)=10-5mol/L,
故答案为:A-+H2O?HA+OH-;10-5;
(2)若该酸为强酸,等体积等浓度混合时pH=7,而HA为弱酸,等体积等浓度混合溶液的pH大于7,则为保证pH=7,应使酸浓度应该大于0.2mol/L;
溶液的pH=7,溶液中c(H+)=c(OH-),由电荷守恒c(Na+)+c(H+)=c(A-)+c(OH-)可知:c(A-)=c(Na+),
故答案为:>;=;
(3)第③组混合溶液中溶质为HA、NaA,HA电离出氢离子,NaA水解生成氢氧根离子,该溶液显酸性,说明HA的电离程度大于NaA的水解程度;溶液中c(A-)>c(Na+),由于水解和电离的程度较小,所以溶液中离子浓度关系为:c(A-)>c(Na+)>c(H+)>c(OH-);
故答案为:>;c(A-)>c(Na+)>c(H+)>c(OH-);
(4)NaA水解显碱性,加水稀释溶液的碱性减弱,pH减小,稀释100倍,pH变化小于2个单位,B曲线符合;
故答案为:B;
(5)NaA为强电解质,完全电离,HA为弱电解质,部分电离,NaA易水解,但较微弱,所以等浓度的NaA和HA中A-浓度盐中大于酸,所以A-离子浓度由大到小的顺序为:乙>丁>甲>丙,
故答案为:乙>丁>甲>丙.
点评 本题考查了离子浓度大小的比较、弱电解质的电离等知识点,题目难度中等,注意掌握溶液酸碱性的定性判断方法,根据①确定酸的强弱,再结合电荷守恒、盐的水解原理等知识进行分析解答.

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案| A. | 反应CO2(g)+C(s)=2CO(g)在高温下可自发进行,则该反应的△H>0 | |
| B. | 工业上电解饱和食盐水时,以石墨作阴极,铁棒作阳极 | |
| C. | 常温下,0.1mol•L-1 CH3COOH溶液pH=1 | |
| D. | 常温下,在AgCl悬浊液中加入少量NaCl饱和溶液,c(Ag+)减小,Ksp(AgCl) 减小和溶液的pH均增大 |
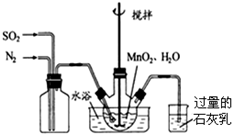
(1)利用如下图所示实验装置制取氧气,请回答有关问题.

①实验室制取CO2的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑.
②表明CO2未被Na2O2完全吸收的实验现象为澄清石灰水变浑浊.
③O2可采用D装置收集,并用带火星的木条检验,这是利用了O2的氧气密度比空气的大,氧气有助燃性性质.
④若A装置产生的CO2中混有水蒸气,要检验干燥的CO2能否与Na2O2反应生成O2,以上实验装置应如何改进在A、B装置之间增加气体干燥装置
(2)为探究X是哪种物质及其有关性质,同学们进行了如下分析和实验.
①有同学猜想X可能是酸、碱或盐中的一种.通过对物质组成的分析,大家一致认为X肯定不是酸和碱,理由是Na2O2和CO2都不含氢元素,根据质量守恒定律,二者反应后不可能生成含氢元素的酸或碱.
②同学们通过讨论和实验证明了X是Na2CO3.以下是他们设计的有关Na2CO3性质的探究实验,将下表填写完整.
| 实验操作 | 现 象 | 有关的化学方程式 |
| 实验一:取少量固体样品,滴加稀盐酸,然后将产生的气体通入澄清石灰水 | 有气泡产生 澄清石灰水变浑浊 | Na2CO3+2HCl=2NaCl+H2O+CO2↑ CO2+Ca(OH)2=CaCO3↓+H2O |
| 实验二:取少量固体样品, 加水配成溶液,滴加适量的氯化钙或 氯化钡等 溶液 | 有白色沉淀产生 | Na2CO3+CaCl2=CaCO3↓+2NaCl或 Na2CO3+BaCl2=BaCO3↓+2NaCl等 |
| A. | 小苏打可以用于面粉发酵 | B. | SO2可用于漂白纸浆 | ||
| C. | BaCO3在医学上用作钡餐 | D. | 醋可用于除去暖水瓶中的水垢 |
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,Cu2O在空气中加热生成CuO
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂.
(1)若假设1成立,则实验现象是溶液变为血红色.
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?不合理.
(3)若固体粉末完全溶解无固体存在,滴加 KSCN 试剂时溶液不变红色,则证明原固体粉末是Fe2O3和Cu2O的混合物,写出发生反应的离子方程式Fe2O3+6H+=2Fe3++3H2O;Cu2O+2H+=Cu+Cu2++H2O;2Fe3++Cu=2Fe2++Cu2+.
探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物.
(4)实验小组欲用加热法测定Cu2O的质量分数.取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为$\frac{9(b-a)}{a}×100%$.
(5)欲利用红色粉末Fe2O3和Cu2O的混合物制取较纯净的胆矾(CuSO4?5H2O),经查阅资料得知,在溶液中调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH[来: | 13 | 14 | 3.7 |
A.氯水
B.H2O2
C.硝酸
D.NaOH
E.氨水
F.Cu2(OH)2CO3
实验小组设计如下实验方案:
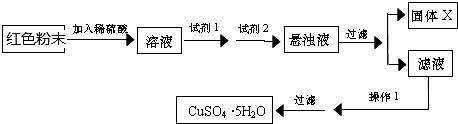
试回答:①试剂I为B,试剂II为F(填字母).
②固体X的化学式为Fe(OH)3.